
据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,有关键能数据如下表:
| 化学键 | Si—O | O===O | Si—Si |
| 键能/kJ·mol-1 | x | 498.8 | 176 |
则x的值为____________。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把________能转化为________能的装置。
(3)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是________(填字母序号)。
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)===Si(s)+4HCl(g) ΔH=240.4 kJ·mol-1,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好完全反应,则反应过程中________(填“吸收”或“释放”)的热量为________kJ。
答案 (1)460 (2)光(或太阳) 电
(3)D (4)吸收 6.01
解析 (1)每摩尔Si含有2 mol Si—Si键,每摩尔SiO2含有4 mol Si—O键,则ΔH=2×176 kJ·mol-1+498.8 kJ·mol-1-4x kJ·mol-1=-989.2 kJ·mol-1,x=460。
(2)硅光电池将光(或太阳)能转化为电能。
(3)硅是固体,便于运输、贮存,A对;硅元素在地壳中含量居于第二位,来源丰富,B对;硅燃烧的产物为SiO2,没有污染,C对;制备硅不需要催化剂,D错。
(4)100 mL 1 mol·L-1 的NaOH溶液消耗0.1 mol HCl,则工业制备纯硅的反应中有0.1 mol HCl生成,故吸收的热量为 ×0.1 mol=6.01 kJ。
×0.1 mol=6.01 kJ。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
核磁共振(NMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的1H—NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为____________。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A是链状化合物与氢气的加成产物,分子中有三个甲基,则A的可能结构有________种(不考虑立体异构)。
②B是链状化合物,1H—NMR谱中只有一个信号,则B的结构简式为______________。
③C是环状化合物,1H—NMR谱中也只有一个信号,则C的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B两种有机物的有关信息:
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为
③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为
|
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物名称叫做______________________________;
写出在一定条件下,A生成高分子化合物的化学反应方程式:__________________。
(2)A与氢气发生加成反应后生成C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_______时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤能使酸性KMnO4溶液和溴水褪色、⑥任何条件下不与氢气反应。
写出在浓硫酸作用下,B与浓硝酸在50~60 ℃反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能源和作为能源的物质叙述错误的是( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D.吸热反应没有利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)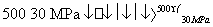 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+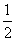 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是 ( )。
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元
素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________
________________________________________________________________。
(3)上图中5号元素在周期表中的位置是______________________________。
(4)上图中4、5、6三种元素中电负性最大的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃以任意比例混合,在105 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
( )。
A.CH4与C2H4 B.CH4与C3H4
C.C2H2与C3H6 D.C2H4与C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com