
ijČÜŅŗÖŠŗ¬ÓŠµÄĄė×ÓæÉÄÜŹĒK+”¢Ba2+”¢A13+”¢Mg2+”¢AlO2©”¢CO32©”¢SiO32©”¢Cl©ÖŠµÄ¼øÖÖ£¬ĻÖ½ųŠŠČēĻĀŹµŃé£ŗ
¢ŁČ”ÉŁĮæČÜŅŗ¼ÓĒāŃõ»ÆÄĘČÜŅŗ¹ż³ĢÖŠĪŽ³ĮµķÉś³É£®
¢ŚĮķȔɣĮæŌČÜŅŗ£¬ÖšµĪ¼ÓČė5mL0.2mol•L©1ŃĪĖį£¬·¢ÉśµÄĻÖĻóŹĒ£ŗæŖŹ¼²śÉś³Įµķ²¢Öš½„Ōö¶ą£¬³ĮµķĮæ»ł±¾²»±äŗó²śÉśĘųĢ壬×īŗó³ĮµķÖš½„¼õÉŁÖĮĻūŹ§£®
¢ŪŌŚÉĻŹö¢Ś³ĮµķĻūŹ§ŗóµÄČÜŅŗÖŠ£¬ŌŁ¼ÓČė×ćĮæµÄĻõĖįŅųČÜŅŗæɵƵ½³Įµķ0.43g£®
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
”” A£® øĆČÜŅŗÖŠŅ»¶Ø²»ŗ¬Ba2+”¢Mg2+”¢A13+”¢SiO32©”¢Cl©
”” B£® øĆČÜŅŗÖŠŅ»¶Øŗ¬ÓŠK+”¢AlO2©”¢CO32©”¢Cl©
”” C£® øĆČÜŅŗŹĒ·ńÓŠK+Šč×öŃęÉ«·“Ó¦£ØĶø¹żĄ¶É«īܲ£Į§Ę¬£©
”” D£® æÉÄÜŗ¬ÓŠCl©
æ¼µć£ŗ ³£¼ūĄė×ӵļģŃé·½·Ø£®
×ØĢā£ŗ ĪļÖŹ¼ģŃé¼ų±šĢā£®
·ÖĪö£ŗ ¢Ł¼ÓĒāŃõ»ÆÄĘČÜŅŗ¹ż³ĢÖŠĪŽ³ĮµķÉś³É£¬ĖµĆ÷ČÜŅŗÖŠŅ»¶Ø²»“ęŌŚA13+”¢Mg2+£»
¢ŚĮķȔɣĮæŌČÜŅŗ£¬ÖšµĪ¼ÓČė5mL0.2mol•L©1ŃĪĖį£¬æŖŹ¼²śÉś³Įµķ²¢Öš½„Ōö¶ą£¬³ĮµķĮæ»ł±¾²»±äŗó²śÉśĘųĢ壬×īŗó³ĮµķÖš½„¼õÉŁÖĮĻūŹ§£¬²śÉśŗĶČܽāµÄ³ĮµķĪŖĒāŃõ»ÆĀĮ£¬²śÉśµÄĘųĢåĪŖ¶žŃõ»ÆĢ¼£¬ĖµĆ÷ČÜŅŗÖŠ“ęŌŚAlO2©”¢CO32©£¬ĖłŅŌŅ»¶Ø²»“ęŌŚSiO32©”¢Ba2+£¬øł¾ŻČÜŅŗµēÖŠŠŌæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚK+£»
¢ŪŌŚÉĻŹö¢Ś³ĮµķĻūŹ§ŗóµÄČÜŅŗÖŠ£¬ŌŁ¼ÓČė×ćĮæµÄĻõĖįŅųČÜŅŗæɵƵ½³Įµķ0.43g£¬³ĮµķĪŖAgCl£¬ĪļÖŹµÄĮæĪŖ£ŗ ”Ö0.003mol£¾n£ØHCl£©=0.001mol£¬ĖłŅŌŌČÜŅŗÖŠŅ»¶Ø“ęŌŚ0.02molCl©£¬¾Ż“Ė½ųŠŠ½ā“š£®
”Ö0.003mol£¾n£ØHCl£©=0.001mol£¬ĖłŅŌŌČÜŅŗÖŠŅ»¶Ø“ęŌŚ0.02molCl©£¬¾Ż“Ė½ųŠŠ½ā“š£®
½ā“š£ŗ ½ā£ŗ¢ŁĻņČÜŅŗÖŠ¼ÓĒāŃõ»ÆÄĘČÜŅŗ¹ż³ĢÖŠĪŽ³ĮµķÉś³É£¬ĖµĆ÷ČÜŅŗÖŠŅ»¶Ø²»“ęŌŚÓėĒāŃõ»ÆÄĘÉś³É³ĮµķµÄĄė×Ó£ŗA13+”¢Mg2+£»
¢ŚĻņŌČÜŅŗÖŠÖšµĪ¼ÓČė5mL0.2mol•L©1ŃĪĖį£¬æŖŹ¼²śÉś³Įµķ²¢Öš½„Ōö¶ą£¬³ĮµķĮæ»ł±¾²»±äŗó²śÉśĘųĢ壬×īŗó³ĮµķÖš½„¼õÉŁÖĮĻūŹ§£»µĪ¼ÓŃĪĖį²śÉśŗĶČܽāµÄ³ĮµķĪŖĒāŃõ»ÆĀĮ£¬ĘųĢåĪŖ¶žŃõ»ÆĢ¼£¬ĖµĆ÷ŌČÜŅŗÖŠ“ęŌŚAlO2©ŗĶCO32©£¬ĖłŅŌŅ»¶Ø²»“ęŌŚ²»ČÜÓŚŃĪĖįµÄSiO32©ŗĶÓėCO32©·“Ó¦µÄBa2+£¬ŌŁøł¾ŻČÜŅŗµēÖŠŠŌæÉÖŖ£ŗČÜŅŗÖŠŅ»¶Ø“ęŌŚĪØŅ»µÄŃōĄė×Ó£ŗK+£»
¢ŪŌŚ¢Ś³ĮµķĻūŹ§ŗóµÄČÜŅŗÖŠ£¬ŌŁ¼ÓČė×ćĮæµÄĻõĖįŅųČÜŅŗæɵƵ½³Įµķ0.43g£¬³ĮµķĪŖAgCl£¬ĪļÖŹµÄĮæĪŖ£ŗ ”Ö0.003mol£»¢ŚÖŠ¼ÓČėµÄĀČĄė×ÓµÄĪļÖŹµÄĮæĪŖ£ŗn£ØHCl£©=0.2mol/L”Į0.005L=0.001mol£¼n£ØAgCl£©£¬ĖłŅŌŌČÜŅŗÖŠŅ»¶Ø“ęŌŚ0.02mol Cl©£¬
”Ö0.003mol£»¢ŚÖŠ¼ÓČėµÄĀČĄė×ÓµÄĪļÖŹµÄĮæĪŖ£ŗn£ØHCl£©=0.2mol/L”Į0.005L=0.001mol£¼n£ØAgCl£©£¬ĖłŅŌŌČÜŅŗÖŠŅ»¶Ø“ęŌŚ0.02mol Cl©£¬
A”¢øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø²»“ęŌŚBa2+”¢Mg2+”¢A13+”¢SiO32©£¬Ņ»¶Ø“ęŌŚCl©£¬¹ŹA“ķĪó£»
B”¢ÓÉ·ÖĪöæÉÖŖ£ŗøĆČÜŅŗÖŠŅ»¶Øŗ¬ÓŠK+”¢AlO2©”¢CO32©”¢Cl©£¬¹ŹBÕżČ·£»
C”¢øł¾ŻČÜŅŗµÄµēÖŠŠŌæÉŅŌÅŠ¶Ļ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚ¼ŲĄė×Ó£¬²»ŠčŅŖĶعżŃęÉ«·“ӦŊ¶Ļ¼ŲĄė×ÓŹĒ·ń“ęŌŚ£¬¹ŹC“ķĪó£»
D”¢øł¾ŻÉś³ÉĀČ»ÆŅų³ĮµķµÄĪļÖŹµÄĮææÉÖŖ£¬ŌČÜŅŗÖŠŅ»¶Ø“ęŌŚĀČĄė×Ó£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ£ŗ ±¾Ģāæ¼²éĮĖ³£¼ūĄė×ӵļģŃ飬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕ³£¼ūĄė×ӵĊŌÖŹ¼°¼ģŃé·½·Ø£¬±¾ĢāÖŠ¼ŲĄė×ÓŗĶĀČĄė×ÓµÄÅŠ¶ĻĪŖÄŃµć£¬×¢Ņāøł¾ŻČÜŅŗµēÖŠŠŌ¼°Éś³ÉĀČ»ÆŅųµÄĪļÖŹµÄĮæÅŠ¶Ļ¶žÕߵēęŌŚĒéæö£®
””


 ¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĪļÖŹµÄČ¼ÉÕČČĻąµČµÄŹĒ£Ø””””£©
”” A£® Ģ¼ŗĶ¶žŃõ»ÆĢ¼ B£® 1molĢ¼ŗĶ3molĢ¼
”” C£® 3molŅŅČ²£ØC2H2£©ŗĶ1mol±½ D£® µķ·ŪŗĶĻĖĪ¬ĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĶéĢžµÄĻµĶ³ĆüĆūÖŠ£¬²»ÕżČ·µÄŹĒ£Ø””””£©
”” A£® 2£¬3﹣¶ž¼×»łĪģĶé B£® 3﹣¼×»ł﹣2﹣ŅŅ»ł¼ŗĶé
”” C£® 3£¬3﹣¶ž¼×»łĪģĶé D£® 2﹣¼×»ł¶”Ķé
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓŠ¼×”¢ŅŅĮ½ÖÖĪļÖŹ£ŗ
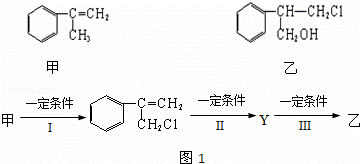
£Ø1£©ŅŅÖŠŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘĪŖ””””£Ø²»°üĄØ±½»·£©£®
£Ø2£©Óɼ××Ŗ»ÆĪŖŅŅŠč¾ČēĶ¼1ĖłŹ¾µÄ¹ż³Ģ£ØŅŃĀŌČ„ø÷²½·“Ó¦µÄĪŽ¹Ų²śĪļ£¬ĻĀĶ¬£©£ŗĘäÖŠ·“Ó¦IµÄ·“Ó¦ĄąŠĶŹĒ””””£¬·“Ó¦¢ņµÄĢõ¼žŹĒ””””£¬·“Ó¦¢óµÄ»Æѧ·½³ĢŹ½ĪŖ””””£Ø²»Šč×¢Ć÷·“Ó¦Ģõ¼ž£©£®
£Ø3£©ĻĀĮŠĪļÖŹ²»ÄÜÓėŅŅ·“Ó¦µÄŹĒ””””£ØŃ”ĢīŠņŗÅ£©£®a£®½šŹōÄĘ b£®äåĖ® c£®Ģ¼ĖįÄĘČÜŅŗ d£®ŅŅĖį
£Ø4£©ŅŅÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ČĪŠ“ĘäÖŠŅ»ÖÖÄÜĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹Ģå½į¹¹¼ņŹ½””””£®
a£®±½»·ÉĻµÄŅ»ĀČ“śĪļÓŠĮ½ÖÖ b£®ÓöFeCl3ČÜŅŗĻŌŹ¾×ĻÉ«£®
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓŠŅ»³ĪĒåĶøĆ÷µÄČÜŅŗ£¬Ö»æÉÄÜŗ¬ÓŠ“óĮæµÄFe3+”¢Fe2+”¢H+”¢AlO2©”¢Al3+”¢CO32©”¢NO3©ĘßÖÖĄė×ÓÖŠµÄ¼øÖÖ£¬ĻņøĆČÜŅŗÖŠÖšµĪ¼ÓČėŅ»¶ØĮæ1mol/L NaOHČÜŅŗµÄ¹ż³ĢÖŠ£¬æŖŹ¼Ć»ÓŠ³Įµķ£¬¶ųŗó²ÅÓŠ³Įµķ£®ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©
”” A£® ČÜŅŗÖŠæÉÄÜŗ¬ÓŠAlO2©
”” B£® ČÜŅŗÖŠæÉÄÜŗ¬ÓŠNO3©
”” C£® ČÜŅŗÖŠŅ»¶Ø²»ŗ¬Fe2+ŗĶFe3+
”” D£® ČÜŅŗÖŠæÉÄÜŗ¬ÓŠFe3+£¬µ«Ņ»¶Ø²»ŗ¬Fe2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijČÜŅŗÖŠ³żĮĖH+”¢OH©ŅŌĶā£¬»¹ŗ¬ÓŠ“óĮæµÄMg2+”¢Fe3+”¢Cl©£¬ĒŅÕāČżÖÖĄė×ÓµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1£ŗ1£ŗ6£¬ĻĀĮŠÓŠ¹ŲøĆČÜŅŗÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©
”” A£® ĻņøĆČÜŅŗÖŠ¼ÓČėKIČÜŅŗŗó£¬ŌÓŠµÄ5ÖÖĄė×ÓµÄĪļÖŹµÄĮæ²»±ä
”” B£® ĻņøĆČÜŅŗÖŠµĪ¼ÓĻ”NaOHČÜŅŗ£¬Į¢¼“³öĻÖ°×É«³Įµķ
”” C£® ĻņøĆČÜŅŗÖŠ¼ÓČė¹żĮæĢś·Ū£¬Ö»·¢ÉśÖĆ»»·“Ó¦
”” D£® ČōČÜŅŗÖŠc £ØCl©£©=0.6mol/L£¬ŌņøĆČÜŅŗµÄpH=1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ij¹¤Ņµ·ĻĖ®ÖŠæÉÄÜŗ¬ÓŠČēĻĀ¼øÖÖŅõŃōĄė×Ó£ŗ
ŃōĄė×Ó Fe3+”¢Al3+”¢Fe2+”¢Ba2+”¢Na+
ŅõĄė×Ó Cl©”¢CO32©”¢NO3©”¢SO42©”¢SiO32©
ĻÖ¶ŌøĆ·ĻĖ®ŃłĘ·½ųŠŠŅŌĻĀŃŠ¾æ£ŗ
¢ń£®ĻņŹŌ¹ÜÖŠµĪ¼ÓÅØŃĪĖį£¬ÓŠÉŁĮæµÄĪŽÉ«ĘųĢåÉś³É£¬ĘųĢåÓöæÕĘųĮ¢¼“±äĪŖŗģ×ŲÉ«£»
¢ņ£®ČōĻņ¢ńĖłµĆµÄČÜŅŗÖŠ¼ÓČėBaCl2ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£®
¢ó£®ČōĻņ¢ńĖłµĆµÄČÜŅŗÖŠ¼ÓČė¹żĮæµÄNaOHČÜŅŗ£¬ÓŠŗģŗÖÉ«³ĮµķÉś³É£®¹żĀĖŗóĻņĖłµĆĀĖŅŗÖŠĶØČė¹żĮæµÄCO2ĘųĢ壬ӊ°×É«Šõד³ĮµķÉś³É£®
øł¾ŻÉĻŹöŹµŃ飬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·ĻĖ®ÖŠŅ»¶Øŗ¬ÓŠµÄŅõĄė×ÓŹĒ””””£¬Ņ»¶Ø²»ŗ¬ÓŠµÄŃōĄė×ÓŹĒ””£»
Š“³ö¢óµÄĖłµĆĀĖŅŗÖŠĶØČė¹żĮæµÄCO2ĘųĢåÉś³É°×É«Šõד³ĮµķµÄĄė×Ó·½³ĢŹ½£ØÖ»Š“ÕāŅ»øö£©£ŗ””£»
£Ø3£©ŅŃÖŖÓĆĀĮ·ŪæÉŅŌ³żČ„·ĻĖ®ÖŠµÄŅ»ÖÖŅõĄė×Ó£ØX£©£®ČōæŲÖĘČÜŅŗµÄpHĪŖ10.7×óÓŅ£¬ŌŁ¼ÓČėĀĮ·Ū£¬³żČ„XĄė×ÓµÄĶ¬Ź±²śÉś°±ĘųŗĶµŖĘų£¬ĒŅĢå»ż±ČĪŖ1©s4£¬Ķź³ÉĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½²¢ÅäĘ½£ŗ£ØXÓĆ¾ßĢåµÄĄė×Ó·ūŗűķŹ¾£©
””””Al+””””X+””7””OH©=””””AlO2©+””””NH3+””””N2+””2H2O””£¬øĆ·“Ó¦µÄ»¹Ō²śĪļŹĒ””£®Čō³żČ„0.2molXĄė×Ó£¬ŅŖĻūŗÄĀĮ””””g£®
£Ø4£©Čō½«·ĻĖ®ÖŠµÄĢśŌŖĖŲĶźČ«×Ŗ»Æ³ÉFe3+£¬“ĖŹ±²āµĆc£ØFe3+£©=1.0”Į10©2mol•L©1£¬ŅŖĻė½«Ęä×Ŗ»»ĪŖFe£ØOH£©3³Įµķ¶ų³żČ„£¬ŌņÓ¦µ÷½ŚČÜŅŗpHÖĮÉŁ“óÓŚ””””£®£ØŅŃÖŖ³£ĪĀĻĀFe£ØOH£©3µÄKsp=1.0”Į10©38£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĢśÄųŠīµē³ŲÓÖ³Ę°®µĻÉśµē³Ų£¬·ÅµēŹ±µÄ×Ü·“Ó¦ĪŖ£ŗFe+Ni2O3+3H2O=Fe£ØOH£©2+2Ni£ØOH£©2£¬ĻĀĮŠÓŠ¹ŲøƵē³ŲµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø£©
A£® µē³ŲµÄµē½āŅŗĪŖ¼īŠŌČÜŅŗ£¬Õż¼«ĪŖNi2O3”¢øŗ¼«ĪŖFe
B£® µē³Ų·ÅµēŹ±£¬øŗ¼«·“Ó¦ĪŖFe+2OH﹣﹣2e﹣=Fe£ØOH£©2
C£® µē³Ų³äµē¹ż³ĢÖŠ£¬Ņõ¼«ø½½üČÜŅŗµÄpH½µµĶ
D£® µē³Ų³äµēŹ±£¬Ńō¼«·“Ó¦ĪŖ2Ni£ØOH£©2+2OH﹣﹣2e﹣=Ni2O3+3H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŖŃųĪļÖŹŌŚČĖĢåÄŚ·¢ÉśµÄ±ä»Æ¼°Ęä¶ŌÉśĆü»ī¶ÆĖłĘšµÄ×÷ÓĆŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | µķ·Ū”śĘĻĢŃĢĒ”ś£ØŃõ»Æ£©Ė®ŗĶ¶žŃõ»ÆĢ¼£ØŹĶ·ÅÄÜĮæĪ¬³ÖÉśĆü»ī¶Æ£© |
| ”” | B£® | ĻĖĪ¬ĖŲ£ØĖ®½ā£©”śĘĻĢŃĢĒ”ś£ØŃõ»Æ£©Ė®ŗĶ¶žŃõ»ÆĢ¼£ØŹĶ·ÅÄÜĮæĪ¬³ÖÉśĆü»ī¶Æ£© |
| ”” | C£® | ÓĶÖ¬”ś£ØĖ®½ā£©øŹÓĶŗĶøß¼¶Ö¬·¾Ėį”ś£ØŃõ»Æ£©Ė®ŗĶ¶žŃõ»ÆĢ¼£ØŹĶ·ÅÄÜĮæĪ¬³ÖÉśĆü»ī¶Æ£© |
| ”” | D£® | µ°°×ÖŹ”ś£ØĖ®½ā£©°±»łĖį°±»łĖį”ś£ØŗĻ³É£©ČĖĢåĖłŠčµÄµ°°×ÖŹ£ØČĖĢåÉś³¤·¢Óż£© |
””
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com