
【题目】某烃的结构简式为: 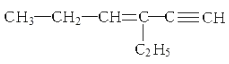 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.1mol该烃完全燃烧消耗11mol O2
B.与氢气完全加成后的产物中含3个甲基
C.1mol该烃完全加成消耗Br2的物质的量为3mol
D.该烃的核磁共振氢谱有12个峰
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( ) 
A.布洛芬的分子式为C13H18O2
B.布洛芬与苯乙酸是同系物
C.1mol 布洛芬最多能与3mol 氢气发生加成反应
D.布洛芬在苯环上发生取代反应,其一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯和溴反应的反应原理,特进行如下实验,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉. 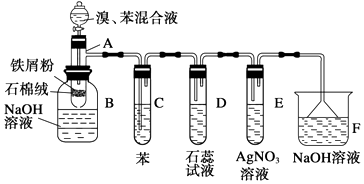
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式):
(2)试管C中苯的作用是 . 反应开始后,观察D的现象为E的现象为
(3)整套装置中,具有防倒吸作用的仪器有(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应aFeCl2+bKNO3+cHCl=- dFeCl3+eKCl+fX+gH2O中,其中a,b,c,d,e,f,g均为相应的物质系数,若b=l.d=3,则生成物X的分子式为
A. NO2 B. NO C. N2O D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据要求填空:
(1) 用系统命名法命名:
用系统命名法命名:
(2)![]() 官能团的名称是
官能团的名称是
(3)分别完全燃烧1molC2H6、1molC2H4、1molC2H2 , 需要氧气最多的是 .
(4)![]() 的分子式为
的分子式为
(5)1mol某不饱和烃可以和1molCl2发生加成反应,生成2﹣甲基﹣2,3﹣二氯戊烷,则该不饱和烃是(写结构简式)
(6)某有机物的分子式为C4H4 , 它有一种同分异构体,每个碳原子均达到饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3 , 以及少量Fe、Si的化合物.可以用孔雀石为原料制备胆矾(CuSO45H2O),步骤如图: 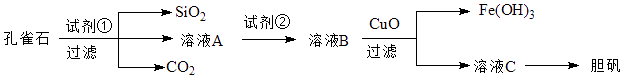
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式 . 过滤所需要的玻璃仪器有
(2)实验室检验Fe3+的常用方法是 .
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+ , 上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+ , 从而形成溶液B,则试剂②能否用氯水(填“能”或“不能”,若“不能”,请解释原因).
(4)由溶液C获得胆矾,需要经过、、过滤等操作.
(5)取25.00mL溶液A,用1.000×10﹣2mol/LKMnO4标准溶液滴定.反应离子方程式为:5Fe2++MnO4﹣+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl26H2O的工艺流程如图1: 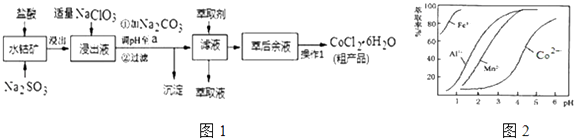
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式 .
(2)写出NaClO3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 .
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 .
(4)制得的CoCl26H2O在烘干时需减压烘干的原因是 .
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是;其使用的最佳pH范围是 . A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl26H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl26H2O的质量分数大于100%,其原因可能是 . (答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2 , 可提高效益,减少污染.
(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)H2O(g)+CuCl2(s)△H1 , 反应②生成1molCl2(g)的反应热为△H2 , 则总反应的热化学方程式为(反应热用△H1和△H2表示). 
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性. ①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 .
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:
③下列措施中,有利于提高αHCl的有 .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10﹣3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以molmin﹣1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com