
分析 恒温恒容下,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,设转化xmol O2,则
2SO2(g)+O2(g)?2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):2x x 2x
平衡量(mol):3-2x 2-x 2x
则$\frac{3-2x+2-x+2x}{3+2}$=90%,
x=0.5,以此解答该题.
解答 解:(1)由以上分析可知转化0.5mol氧气,则反应放出的热量为196.6KJ×$\frac{0.5mol}{1mol}$=98.3KJ,
答:达到平衡时,反应放出的热量为98.3kJ;
(2)达到平衡时,三氧化硫的物质的量为2×0.5mol=1mol,则体积分数为$\frac{1}{4.5}$=$\frac{2}{9}$,
答:达到平衡时三氧化硫的体积分数$\frac{2}{9}$.
点评 本题为化学平衡和反应热综合试题,为高频考点,侧重考查学生的分析能力和计算能力,注意把握题目数据的分析,难度中等.


科目:高中化学 来源: 题型:实验题
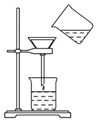 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
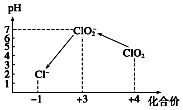 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | 2 min内A的反应速率为0.3 mol•(L•min)-1 | |
| C. | 维持其他条件不变,将该混合物转移到固定容积为1 L的密闭容器中,再次平衡后H的浓度将大于0.4 mol•L-1 | |
| D. | 维持其他条件不变,再向容器中加入足量物质 A,最终H的浓度将达到0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
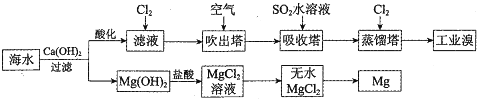
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
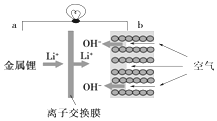
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
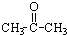 ③CH3CH2Br④
③CH3CH2Br④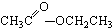 ⑤
⑤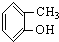 ⑥
⑥ ⑦
⑦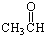 ⑧
⑧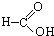 ⑨
⑨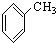 ⑩
⑩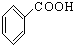
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com