
【题目】下列指定反应的离子方程式正确的是
A.用KIO3溶液氧化酸性溶液中的KI:5I-+ IO3- + 3H2O = 3I2 + 6OH-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2![]()
C.Cu溶于稀HNO3:Cu + 2H+ + NO3- = Cu2+ + NO2↑+ H2O
D.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O
【答案】D
【解析】
A.KIO3氧化酸性溶液中的KI产物中不能生成氢氧根离子,反应的离子方程式为:5I-+ IO3- +6H+═3I2+3H2O,故A错误;
B. 醋酸溶液除水垢中的CaCO3反应的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO+H2O+CO2↑,故B错误;
C.Cu溶于稀HNO3生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu +8H+ + 2NO3- = ═3Cu2++2NO↑+4H2O,故C错误;
D.Ca(HCO3)2溶液与足量NaOH溶液反应,离子方程式:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
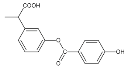
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是()
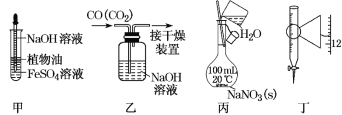
A.用装置甲观察Fe(OH)2的生成
B.用装置乙除去CO中的CO2
C.用装置丙配制一定物质的量浓度的NaNO3溶液
D.装置丁为25mL滴定管,读数为11.80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中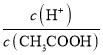 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A.CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L1]:c(Na+)=c(CH3COO)>c(CH3COOH)>c(H+)=c(OH)
B.20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7:c(CH3COOH)=c(Cl)
C.0.1 mol·L1 CH3COOH溶液与0.1 mol·L1 Na2CO3溶液等体积混合(无气体逸出):c(![]() )>c(CH3COOH)+c(H2CO3)
)>c(CH3COOH)+c(H2CO3)
D.0.4 mol·L1 CH3COOH溶液和0.2 mol·L1 NaOH溶液等体积混合(pH<7):c(CH3COOH)>c(CH3COO)>c(Na+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.相对分子质量为72的某烷烃,一氯代物有4种
B.四苯基乙烯![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
D.![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。已知SO2具有:A.酸性、B.氧化性、C.还原性、D.漂白性。
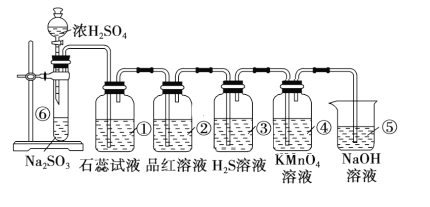
试回答:
(1)①中的现象为__,证明SO2具有__性(请填字母);
(2)②中的品红溶液__,证明SO2有__性(请填字母);
(3)④中的现象是__,证明SO2有__性(请填字母);
(4)⑤的作用是___,试写出该反应的离子反应方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com