
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如所示。由图可得出的正确结论是
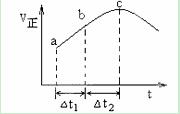
A.反应在c点达到平衡状态
B.△t1=△t2时,SO2的转化率:a~b段小于b~c段
C.反应物的总能量低于生成物的总能量
D.反应物浓度:a点小于b点
科目:高中化学 来源: 题型:
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
A.HCl中H—Cl键的极性和HF中H—F的极性
B.乙烯CH2=CH2中碳碳σ键的键能和碳碳π键的键能
C.1mol金刚石晶体中C-C键数目和1mol SiO2晶体Si—O键数目
D.MgCl2晶体的熔点与AlCl3晶体的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间
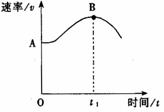 的关系可由右图表示。
的关系可由右图表示。
(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度
④Cl-的浓度 能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 ;
(4)解释图中t1时刻后速率变小的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+Br2(l)=2HBr(g) △H= -72kJ·mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,断裂1mol气态 H2、 Br2、HBr分子内的化学键分别需要吸收的能量为436kJ、akJ、369kJ,则数据a为
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼
B.原电池中电子从负极经过溶液流向正极
C.电解池中电解质溶液的阳离子向阴极迁移
D.在铁制品上镀银,铁做正极,银做负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是:( )
A.H2、D2、T2互为同位素
B.金属氧化物均为碱性氧化物
C.质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒。其核外电子数为53
D. S2-的结构示意图: 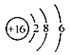
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.“氯碱工业”通过电解饱和食盐水生产氯气和烧碱。
B.通常状况下,干燥的氯气能和Fe反应
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸
D.新制氯水具有漂白性,久置氯水最终变为稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史。目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒。氯气之所以长期用于自来水消毒,原因是( )
A.氯气有毒,可以毒死细菌、病毒
B.氯气具有刺激性气味,可以熏死细菌、病毒
C.氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒
D.氯气用于自来水消毒没有任何有毒物质残留
查看答案和解析>>
科目:高中化学 来源: 题型:
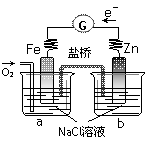
根据右图,下列判断正确的是
A.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高
C.烧杯b中发生的电极反应为Zn-2e-=Zn2+
D.向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com