
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器.它是一种带有磨口玻璃塞的细长颈、梨形的平底玻璃瓶,颈上有刻度.当瓶内体积在所指定温度下达到标线处时,其体积即为所标明的容积数.常和移液管配合使用.容量瓶有多种规格,小的有5ml、25ml、50ml、100ml,大的有250ml、500ml、1000ml、2000ml等.它主要用于直接法配制标准溶液和准确稀释溶液以及制备样品溶液.容量瓶也叫量瓶.
解答 解:容量瓶,是一种细颈梨形平底的容量器,带有磨口玻塞,颈上有标线,表示在所指温度下液体液体凹液面与容量瓶颈部的标线相切时,溶液体积恰好与瓶上标注的体积相等.容量瓶上必须标明是容量、刻度线、温度,
故选A.
点评 本题考查容量瓶的使用,题目难度不大,注意知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2 | |
| B. | Li2CO3受热很难分解 | |
| C. | 在相同温度下,溶解度Li2CO3小于LiHCO3 | |
| D. | 少量的锂保存在固体石蜡中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol/L | B. | 0.10 mol/L | C. | 0.05 mol/L | D. | 0.20 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| B. | 因为高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 | |
| C. | SiO2是酸性氧化物,它不溶于水也水溶于任何酸 | |
| D. | 在制玻璃、制水泥的工业生产中,都需要的原料之一是纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
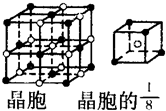 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水. ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是
”表示)均位于小正方体中心.该化合物的电子式是 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com