
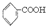
 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 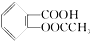 转变为
转变为 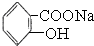 ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
 我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
| ||
| ||
| ||
| 太阳光 |
| ||
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| B、pH=3的盐酸和pH=11的氨水等体积混合 |
| C、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| D、pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶液中加入少量稀NaOH溶液:NH4++OH-=NH3?H2O |
| B、FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C、硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O |
| D、在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A、①②两溶液中c(OH-)相等 |
| B、①溶液的物质的量浓度为0.01 mol?L-1 |
| C、①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② |
| D、等体积的①②两溶液分别与0.01 mol?L-1的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
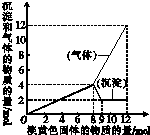 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com