
| A. | 加水稀释10倍后,溶液的pH=4 | |
| B. | c(SO32-)+c(OH-)=c(H2SO3)+c(HSO3-) | |
| C. | 2c(SO32-)+c(HSO3-)+c(H2SO3)=0.02mol•L-1 | |
| D. | $\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$约为5×10-5 mol•L-1 |
分析 A、电离过程是吸热过程,加水稀释促进电离;
B、结合溶液中电荷守恒和物料守恒计算分析判断;
C、依据溶液中物料守恒可知n(Na)=n(S);
D、依据电离平衡常数K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$计算判断.
解答 解:A、电离过程是吸热过程,加水稀释促进HSO3-电离,加水稀释10倍后,溶液的pH<4,故A错误;
B、0.021mol•L-1NaHSO3溶液中电荷守恒为c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),物料守恒为:c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+),则得到c(OH-)+c(SO32-)=c(H2SO3)+c(H+),故B错误;
C、由溶液中物料守恒可知,硫元素存在形式总和与钠元素相同,n(Na)=n(S),c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)=0.02mol•L-1,故C错误;
D、某温度下,0.02mol•L-1NaHSO3溶液的pH约为3,电离平衡常数K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.02-1{0}^{-3}}$≈5×10-5,故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,电荷守恒、物料守恒的计算应用,电离和水解的影响因素分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 所有的放热反应不加热都能进行 | |
| B. | 任何化学反应的发生一定伴有能量变化 | |
| C. | 吸热反应和放热反应都需要加热才能发生 | |
| D. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
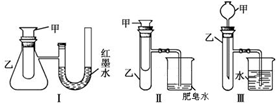
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
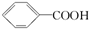 >H2CO3>
>H2CO3>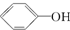 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 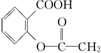 转变为
转变为 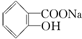 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与足量的NaOH溶液共热后,再加入适量H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-2119.6kJ/mol | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1559.8kJ/mol | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1559.8kJ/mol | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com