
在 10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是
10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是
A.纳米铜是一种新型化合物 B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同 D.纳米铜无需密封保存
科目:高中化学 来源: 题型:解答题
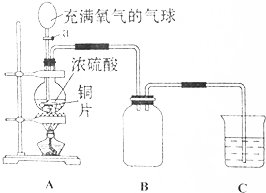 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全燃烧生成二氧化碳和水的化合物不一定是烃 | |
| B. | 相同质量的正丁烷和异丁烷分别完全燃烧,耗氧量相等 | |
| C. | 相同物质的量乙烯和乙醇分别完全燃烧,耗氧量相等 | |
| D. | 相同质量的乙烷和乙炔分别完全燃烧,耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:实验题

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。

(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
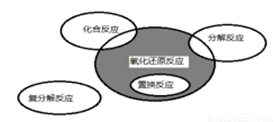
氧化还原反应与四种基本类型反应的关系如 图所示,则下列化学反应属于阴影部分的是
图所示,则下列化学反应属于阴影部分的是
A. CuSO4+Mg=Cu+MgSO4
CuSO4+Mg=Cu+MgSO4
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.2Na2O2+2CO2=2Na2CO3+O2
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
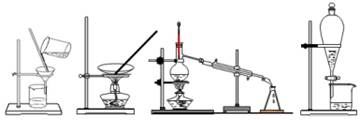
下列四种化学实验操作名称从左到右分别是
A. 过滤、蒸发、蒸馏、萃取 B. 过滤、蒸馏、蒸发、萃取
C. 蒸发、蒸馏、过滤、萃取 D. 萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:计算题
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(1)若某可逆反应的化学平衡常数表达式为:K=C(CO)·C(H2)/C(H2O)
写出该反应的化学方程式:_____________________。
(2) CO(g)+H2O(g) CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状
CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状 态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(易混易错题组)有关物质的量浓度的计算
(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为_________mol/L。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_________mol/L。

(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为__________mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取___________mL上述浓盐酸进行配制。
(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为__________mol/L
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为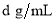 ,则此溶液的物质的量浓度为 mol/L
,则此溶液的物质的量浓度为 mol/L
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
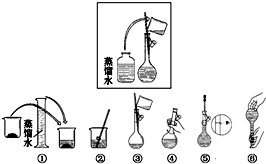 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com