
【题目】关于如图所示的分子,下列叙述正确的是( )

A.该分子最多有22个原子在同一平面内
B.1mol该物质完全燃烧消耗16molO2
C.除苯环外的其余碳原子有可能在一条直线上
D.1mol该物质与足量溴水反应,最多消耗5molBr2
【答案】A
【解析】
分析题给的信息,该分子中含有碳碳双键和苯环。考虑原子共线共面问题可根据与苯环、双键直接相连的原子共平面进行分析判断,同时注意题干要求是“可能”、“一定”、“最多”、“最少”、“所有原子”、“碳原子”等关键词和限制条件。
A.与苯环和碳碳双键直接相连的原子在同一个平面上,甲基中各有一个H原子可与苯环共平面,故该分子中最多共有22个原子共平面,A项正确;
B.该物质的分子式为C12H14,根据烃的燃烧规律可知,1mol该物质完全燃烧耗氧量为![]() ,B项错误;
,B项错误;
C.该物质分子中含有碳碳双键,即具有乙烯的结构特点,乙烯的键角为120°,而非180°,则除苯环外的其余碳原子不可能在同一直线上,C项错误;
D.该分子中只有碳碳双键与溴水反应,1mol该物质含有2mol碳碳双键,故1mol该物质与足量溴水反应,消耗2molBr2,D项错误;
答案选A。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4通常为晶体,易溶于水,试回答下列问题:
(1)NaHSO4在物质分类中属于________,
A 钠盐 B 含氧酸 C 酸式盐 D 氧化物
写出NaHSO4在熔融状态下的电离方程式_____________。NaHSO4水溶液能否与Mg反应?________(填“能”或“否”),如果能,写出离子方程式:_________(如果不能此问不作答)
(2)某同学探究溶液的导电性与离子浓度的关系,做了实验,滴定管是用于滴加溶液的仪器。
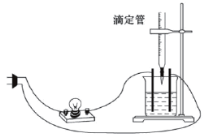
①若烧杯中所盛液体是NaHSO4溶液,滴定管内是Ba(OH)2溶液,随着Ba(OH)2溶液的滴加,灯泡逐渐变暗,当滴加至溶液呈中性时的离子方程式:_______,继续滴加,发生反应的离子方程式为:__________。
②下列哪种组合可使滴加过程中灯泡先变亮后变暗_______
A 向醋酸中滴加相同浓度的氨水
B 石灰乳中滴加稀盐酸
C 向盐酸中滴加相同浓度的氢氧化钠溶液
D 向醋酸钠溶液中滴加相同浓度的盐酸至过量
③若将NaHSO4换成NH4HSO4溶液,加入足量的Ba(OH)2溶液,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:
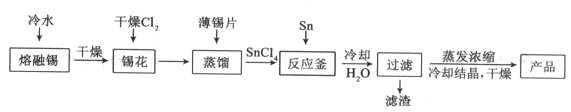
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;
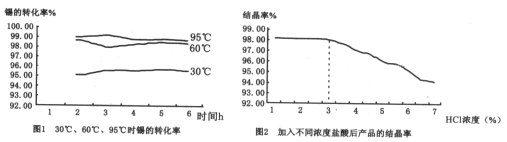
(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100molL-1的NH4SCN溶液滴定25.00mL0.100molL-1AgNO3溶液,以NH4Fe(SO4)212H2O为指示剂,测得溶液中pSCN=lgc(SCN-)、pAg=lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )
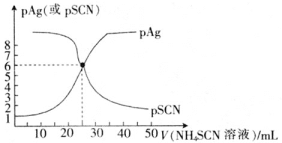
A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和一元醇40.8g和足量金属Na反应,生成标准状况下氢气为4.48L,该醇可催化氧化生成醛的结构可能有( )
A.4种B.7种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
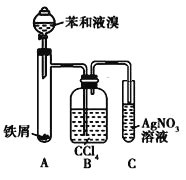
(1)装置C中观察到的现象是_____,证明_____。
(2)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_____,原因是_____;
(3)如果没有装置B,将装置A、C直接相连,则该套实验装置 _____(填“合理”或 “不合理”),原因是_____。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_____(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
| |
①配制0.l0mol/L NaOH溶液 | ②除去CO中的CO2 |
| |
③苯萃取碘水中的I2,分出水层后得到I2的操作 | ④记录滴定终点读数为12.20mL |
A.①B.②C.③D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com