
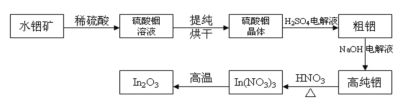
����Ŀ��In�ǵ�5����IIIA��Ԫ�أ�In2O3��һ�����ĵ�����ϣ��������ڴ�������Һ����ʾ���ȸ߿Ƽ���������ˮ������Ҫ�ɷ�In(OH)3���Ʊ�In2O3�Ĺ����������£�
��1��д��ˮ�����������ܵ����ӷ���ʽ��_____________________________
��2������������Һ���Ʊ������������ʵ�鲽�裺__________��_________�����ˡ�ϴ�Ӻ��
��3���ᴿ�����ķ�����ͭ�ľ���ԭ�����ƣ������Ϊ___________��������������������������д�������ĵ缫��Ӧʽ_________________________��
��4��������л�ѧ����ʽ��__________
![]() In(NO3)3
In(NO3)3![]()
![]() In2O3
In2O3![]()
��5����֪t��ʱ����ӦIn2O3��CO![]() 2InO��CO2��ƽ�ⳣ��K=0.25��
2InO��CO2��ƽ�ⳣ��K=0.25��
i��t��ʱ����Ӧ�ﵽƽ��ʱ��n(CO):n(CO2)=___________��
ii����1L���ܱ������м���0.02mol��In2O3��s������ͨ��x mol��CO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱIn2O3��ת����Ϊ50%����x=_________��
��6���ߴ�����Ũ���ᷴӦ�����в�����NO2������Ա�Na2O2ֱ�����գ����״����672mlNO2���Ա�______g Na2O2���ա�NO2���ŷŻ�����һϵ�еĻ������⣬��дһ��������Ļ������⣺_____________ ��
���𰸡�In(OH)3 + 3H+ = In3+ + 3H2O ����Ũ�� ��ȴ�ᾧ ���� In3+ + 3e- = In 4In(NO3)3![]() 2In2O3+12NO2��+3O2�� 4 0.05 1.17 �⻯ѧ����������������
2In2O3+12NO2��+3O2�� 4 0.05 1.17 �⻯ѧ����������������
��������
����Ҫ�ɷ�ΪIn(OH)3��ˮ�����ܽ���ϡ���ᣬ��������к�ԭ���õ�����������Һ������Һ����Ũ������ȴ�ᾧ�����˲�ϴ�ӡ�����õ����������壬�����þ�����ϡ�����Ϻ���ɵõ�����������NaOH��ҺΪ���Һ�����д��������õ��ߴ�������ߴ����ܽ���ϡ���ᣬ��ͨ�����ȴٽ��������ֽ�ɵõ�In2O3���ݴ˷������
(1)In(OH)3�ܽ���ϡ���ᣬ������Ӧ�����ӷ���ʽΪIn(OH)3+3H+=In3++3H2O���ʴ�Ϊ��In(OH)3+3H+=In3++3H2O��
(2)������������Һ�л������������ķ���������Ũ������ȴ�ᾧ�����ˡ�ϴ�Ӻ���ʴ�Ϊ������Ũ������ȴ�ᾧ��
(3)��⾫�������ᴿʱ������Ϊ������������In3+������ԭ��Ӧ���缫��ӦʽΪIn3++3e-=In���ʴ�Ϊ��������In3++3e-=In��
(4)�����������ֽ⣬����Ϊ������������������������������Ӧ�ķ���ʽΪ��4In(NO3)3 ![]() 2In2O3+12NO2��+3O2�����ʴ�Ϊ��4In(NO3)3
2In2O3+12NO2��+3O2�����ʴ�Ϊ��4In(NO3)3 ![]() 2In2O3+12NO2��+3O2����
2In2O3+12NO2��+3O2����
(5)������ӦIn2O3+CO2InO+CO2��ƽ�ⳣ��K=![]() =0.25������ͬһ�����У������Ũ��֮�ȵ������ʵ���֮�ȣ�
=0.25������ͬһ�����У������Ũ��֮�ȵ������ʵ���֮�ȣ�![]() =
=![]() =4���ʴ�Ϊ��4��
=4���ʴ�Ϊ��4��
��.0.02mol��In2O3(s)�ڷ�Ӧ�ﵽƽ��ʱת����Ϊ50%����֪�μӷ�Ӧ��In2O3������Ϊ0.01mol��ͬʱ�μӷ�Ӧ��CO�����ɵ�CO2�����ʵ���ҲΪ0.01mol���ݢ�֪ƽ��ʱ![]() =4����
=4����![]() =4����ã�x=0.05mol���ʴ�Ϊ��0.05mol��
=4����ã�x=0.05mol���ʴ�Ϊ��0.05mol��
(6)672mLNO2��������ʵ���Ϊ![]() =0.03mol����nmolNa2O2ֱ�����գ�����ݵ����غ㣺0.03mol��1=nmol��2����ã�n=0.015mol��Na2O2������Ϊ0.015mol��78g/mol=1.17g������NO2�����ŵ������У�����ɹ⻯ѧ���������������꣬�ʴ�Ϊ��1.17���⻯ѧ���������������ꡣ
=0.03mol����nmolNa2O2ֱ�����գ�����ݵ����غ㣺0.03mol��1=nmol��2����ã�n=0.015mol��Na2O2������Ϊ0.015mol��78g/mol=1.17g������NO2�����ŵ������У�����ɹ⻯ѧ���������������꣬�ʴ�Ϊ��1.17���⻯ѧ���������������ꡣ


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ��Cʱ��MOH��Kb=10-7�����¶��£���20.00 mL0.1 mol�� L-1 MCl��Һ�е���0.1 mol��L-1NaOH��Һ����Һ��pH������NaOH��Һ�������ϵ��ͼ��ʾ������˵���������
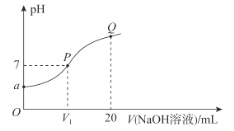
A.a=4B.V1=10
C.��Һ��ˮ�ĵ���̶ȣ�P>QD.Q����Һ��c(Na+)<2c(M+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ��ͼ��ȷ���ǣ� ��
A. ʵ�����Ʊ����ռ���ϩ
B. ʯ�ͷ���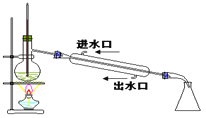
C. ʵ������������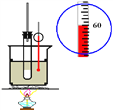
D. ʵ��������Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����ˮ�к�����ᵼ�����ж���ˮ�����ܽ������Ҫ��As(��)�������κ�As(��)��������ʽ���ڡ�
(1)������Ϊͬһ����Ԫ�أ����ԭ������Ϊ________________��
(2)����Ԫ�������ɣ�����˵����ȷ����__________________��
a.���ԣ� H2SO4��H3PO4��H3AsO4
b.ԭ�Ӱ뾶��S��P��As
c.�ǽ����ԣ�S��P��As
(3)���ڵ���ˮ�������Դ�ж��ּ��裬����һ����Ϊ�Ǹ�����Ļ�����(FeS2)������ΪFe(OH)3��ͬʱ����SO42-���������������������ˮ��FeS2��O2���������ӷ���ʽΪ______��
��.(4)A��B��C��X����ѧ��ѧ���������ʣ�A��B��C���ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��
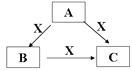
��A��B��C�о���ͬһ�ֳ�������Ԫ�أ���Ԫ����C������������ʽ���ڣ���A��C��ˮ��Һ��Ͽɵ�B�İ�ɫ��״������
��A�к��еĽ���Ԫ��Ϊ________(дԪ������)���������ڱ��е�λ��Ϊ______��
�ڸý���Ԫ�صĵ�����ij�������ڸ����·�Ӧ�������ں������켰�����ƣ��÷�Ӧ�Ļ�ѧ����ʽΪ________��
��.�����仯�������������й㷺Ӧ�á�
(5)Fe3+��̬��������Ų�ʽΪ______��
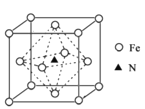
(6)����������ľ����ṹ��ͼ��ʾ���þ�������������������֮��Ϊ______��
(7)ij���Ļ�����ṹ��ʽ��ͼ��ʾ��
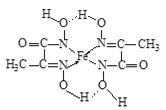
�������������������еķǽ���Ԫ�صĵ縺���ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
�������������е�ԭ�ӵ��ӻ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧС���ͬѧ��չ��һϵ�еĻ�ѧʵ����
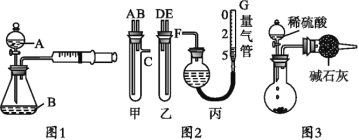
�������ʵ�鲢�����������:
��1����ͬѧ��ͼ1��ʾװ��,����п�����ᷴӦ����:��2 g п��������ƿ��,ͨ����Һ©������1 mol��L-1ϡ����40 mL,�ռ�10 mL����,ͨ����¼______�õ���Ӧ����Ϊx mol����L��min��-1��ʵ�鿪ʼʱ����װ�������Եķ�����_____��
�ټס������Թܸ�����������,�������Ӷ�Ӧ�ӿں�,����ʢϡ������Թ�,������Ӧ,�ų�����,����������ϡ����Ӧ�ֱ�����___��__�����У���������ţ�;
��G�ܿ����û�ѧʵ�������һ�ֳ������������,����������������___;
�������ס��ҽӿڵ����ӷ�ʽ����:A����__,B����___,C����___����д���ӿڵı�ţ�;
��Ϊ��߲�����ȷ��,�ռ��������,��װ�ö���ǰӦ���еIJ�����____��
��3����ͬѧ���ͬѧʵ��Ŀ����ͬ:��ͼ3װ�òⶨ���ɵ�CO2������,����װ�ô�������ȱ��,�Ӷ�����ʵ�����___,�����������ʹ�ⶨ�������ƫ�����Ҫԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬���ڴ�������ת��Ϊ�����壬��Ӧ�����е������仯��ͼ��ʾ������˵����ȷ����

A. �������ʹ��Ӧ�ġ�H��С
B. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2O(g)+CO(g)===CO2(g)+N2(g) ��H= - 226 kJ��mol-1
C. ��Ӧ����ܼ��ܴ�����������ܼ���
D. �÷�Ӧ����Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��ӦI��CH3OH(g)![]() HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
��ӦII��CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
��ӦIII��H2(g)+1/2O2(g)![]() H2O(g) ��H3=��241.8kJ��mol��1
H2O(g) ��H3=��241.8kJ��mol��1
����Ӧ��
��ӦIV��CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
��1�����㷴Ӧ���ķ�Ӧ����H2=____________________________________________��
��2��750K�£��ں����ܱ������У�������ӦCH3OH(g)![]() HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
��3��Na2CO3�Ǽ״������Ƽ�ȩ�Ĵ��������о�ָ��������Ӧ�IJ��ֻ������£�
����i��CH3OH��H+��CH2OH
����������CH2OH����H+HCHO
����������CH2OH��3��H+CO
����iv����H+��H��H2
��ͼ��ʾһ���������¶ȶ�̼���ƴ��������ܵ�Ӱ�죬�ش��������⣺
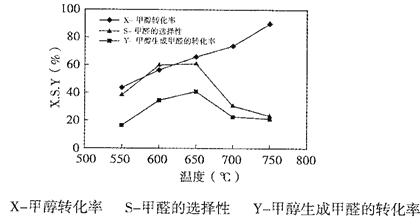
�ٴ�ƽ��ǶȽ���550��-650���״����ɼ�ȩ��ת�������¶����ߵ�ԭ��___________��
�ڷ�Ӧ����i�Ļ��___________(����>����<������=��)CH3OH(g)![]() HCHO(g)+H2(g)��ܡ�
HCHO(g)+H2(g)��ܡ�
��650��~750������Ӧ����ii������___________(����>������<������=��)��Ӧ�����������ʡ�
��4�������Ǵ�����ȩ��ˮ��һ�ֹ��գ��������ʿ��÷���v=0.0423c(mg��L��1��h��1)��ʾ(����cΪ��ȩŨ��)���±�Ϊ�����¼�ȩ��Ũ���洵��ʱ��仯���ݡ�
Ũ��(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
����ʱ��(h) | 0 | 7 | 23 | 39 | 55 |
��ȩŨ��Ϊ2000mg/Lʱ���䴵������v=___________ mg��L��1��h��1�������ϱ����ݣ���ʼŨ��Ϊ10000mg/L������ȩŨ�Ƚ�Ϊ5000mg/L������ʱ��Ϊ___________h��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ������ǣ�������
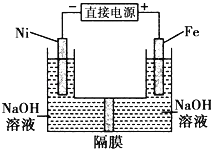
A.Fe�缫���������缫��ӦΪFe��6e��+4H2O�TFeO42��+8H+
B.���ʱ������������Ni�����Һ��Fe�缫������
C.����ĤΪ�����ӽ���Ĥ���������ż�����Һ�к���FeO42��
D.���ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ����Һ��Ϻ���ԭ��Һ��ȣ�������pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ij���л�����ӵ����ģ��ͼ��ͼ�е�����������������˫������ͬ��С���������������ֲ�ͬ�Ķ�����Ԫ�ص�ԭ�ӡ��Ը��л������������ȷ����(����)

A.���л�����ܵķ���ʽΪC2HCl3
B.���л���ķ�����һ����![]()
C.���л�������е�����ԭ����ͬһƽ����
D.���л����������ϩ���Ȼ���ӳɷ�Ӧ�õ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com