
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;结合原子守恒和电荷守恒配平书写离子方程式;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,依据原子守恒书写;
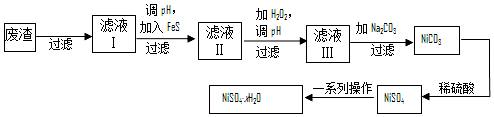
(4)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,以此解答,
①FeS除去Zn2+的反应是沉淀的转化;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;
故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4═Ti+4NaCl;
故答案为:4Na+TiCl4═Ti+4NaCl;
(4)①FeS除去Zn2+的反应是沉淀的转化,即FeS+Zn2+=ZnS+Fe2+,
故答案为:FeS+Zn2+=ZnS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+;
故答案为:氧化Fe2+;除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
点评 本题考查了元素化合物性质的分析应用,主要是氧化还原反应的离子方程式书写方法和产物判断,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③<②<① | D. | 最高正化合价:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012kg碳所含的碳原子数就是阿伏加德罗常数 | |
| B. | 阿伏加德罗常数没有单位 | |
| C. | 阿伏加德罗常数通常用NA表示,6.02×1023称为阿伏加德罗常数 | |
| D. | 阿伏加德罗常数个粒子的集体就是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,使N2和H2混合气体有利于合成氨 | |
| B. | 高压比常压条件更有利于合成氨的反应 | |
| C. | 700K左右比室温更有利于合成氨的反应 | |
| D. | 合成氨时采用循环操作,可提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 用苯萃取碘水中的碘单质,液体分层,上层为紫红色 | |
| C. | 蒸馏时温度计的水银球应插在液面下 | |
| D. | 食用油和水分离,四氯化碳和水分离,均可用分液漏斗,且油层从下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
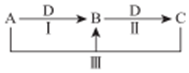 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com