
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)=2NO(g) ΔH>0 ,已知该反应在240℃,平衡常数K=6.4×10-3。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______________.
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______________.
A. 消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C. 混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
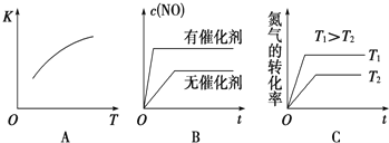
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______![]() 填字母序号
填字母序号![]() 。
。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数___________
与原平衡状态相比,此时平衡混合气中NO的体积分数___________![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应________________________![]() 填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”
填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”![]()
【答案】0.05mol/(L·min) AD AC 不变 向正反应方向进行
【解析】
(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)2NO(g),可知△n(N2)=0.5mol,再根据![]() 计算v(N2);
计算v(N2);
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大;
B.加入催化剂,反应速率增大,但平衡不发生移动;
C.升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等;
(5)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行。
(1)5分钟内,△n(O2)=1mol0.5mol=0.5mol,由N2(g)+O2(g)2NO(g)可知△n(N2)=0.5mol,v(N2)=![]() ═0.05 mol/(Lmin);
═0.05 mol/(Lmin);
(2)A. 消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,到达平衡状态,A项正确;
B. 混合气体总质量不变,容器容积不变,混合气体密度始终不变,B项错误;
C. 混合气体总质量不变,反应前后气体物质的量不变,混合气体平均相对分子质量始终不变,C项错误;
D. 由方程式可知2v(N2)正=v(NO)正,而2v正(N2)=v逆(NO),则v正(NO)=v逆(NO),处于平衡状态,D项正确;
故答案选:AD;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,A项正确;
B. 加入催化剂,反应速率增大,但平衡不发生移动,NO浓度不变,B项错误;
C. 升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,C项正确,
故答案为:AC;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等,此时平衡混合气中NO的体积分数不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×101mol/L、4.0×102mol/L和3.0×103mol/L,浓度商Qc=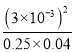 =9×104<K=64×104,则反应应向正反应方向进行。
=9×104<K=64×104,则反应应向正反应方向进行。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,A为新型高效的甲烷燃料电池,采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料、电解质溶液见图。

(1)甲烷燃料电池正极、负极的电极反应式分别为____;____。
(2)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为___极,通电一段时间后,观察到滤纸c端出现的现象是_____。
(3)已知C装置中溶液为AgNO3溶液,D装置的溶液为Cu(NO3)2溶液,打开K1,关闭K2,通电一段时间后,D装置中Cu极的电极反应式为____,C装置中总反应的离子方程式为___。
(4)若C装置中AgNO3溶液足量,且溶液体积为1L,电解一段时间后,C装置中产生O2的体积为0.56 L(标准状况下),则电路通过的电子的物质的量为___,溶液的pH为___(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 收集氯气用排饱和食盐水的方法
B. 加压条件下有利于SO2和O2反应生成SO3
C. 将NO2球浸泡在热水中颜色加深
D. 加催化剂,使N2和H2在一定的条件下转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾配制1L0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水里
B.称取胆矾25g,溶解在1L水里
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关问题:
(1)用0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出__________kJ的能量。
(2)如图所示装置中,仪器A的名称是_______________,作用是___________________________;碎泡沫塑料的作用是__________________________________。
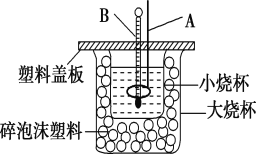
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮水安全在灾后重建中具有极其重要的地位,某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质、一处含有E物质,A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B__,D__。
(2)将含1molA的溶液与含1molE的溶液充分反应,仅得到一种化合物,该化合物为__。(填化学式)
(3)写出实验②发生反应的离子方程式__。
(4)C常用作净水剂,用离子方程式表示其净水原理__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
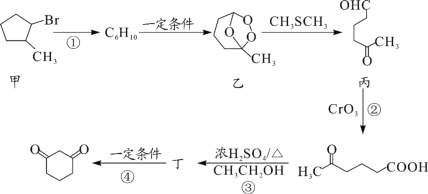
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com