
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 第三周期元素形成的简单离子中,半径最小的是Al3+ | |
| C. | 用电子式表示HCl形成过程: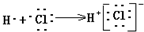 | |
| D. | 水分子很稳定性是因为水分子间易形成氢键 |
分析 A.第VⅡA族元素的氢化物中,HF中存在氢键,导致其沸点最高;
B.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.水分子的稳定性取决于O-H键的键能大小.
解答 解:A.HF中才氢键,大大增强了分子间作用力,则第VⅡA族元素形成的氢化物中沸点最高的是HF,故A错误;
B.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小,第三周期移动离子半径先减小后增大,离子半径最小的是Al3+,故B正确;
C.HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,故C错误;
,故C错误;
D.水分子很稳定性是因为水分子间具有较强的H-O键,与氢键无关,故D错误;
故选B.
点评 本题考查较为综合,涉及原子结构与元素性质、用电子式表示化合物形成过程、氢键与化学键等知识,题目难度不大,明确氢键与化学键对物质性质的影响为解答关键,试题培养了学生的灵活应用能力.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 含非极性键的分子一定是非极性分子 | |
| B. | 含有极性键的分子一定是极性分子 | |
| C. | 双原子极性分子一定含有极性键 | |
| D. | 非极性分子一定含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①⑤ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氮气中含NA个氮原子 | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 18 g水中所含的氢原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为4NA个 | |
| D. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 反应前后左室的压强相同 | |
| B. | 开始时左右两室中的分子数相同 | |
| C. | 反应后容器内的密度与反应前的相同 | |
| D. | 反应后容器内无O2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Mg2+、Na+、SO42-、Cl- | |
| C. | 加入 Al 能放出 H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 酸性溶液中:K+、Cl-、NO3-、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com