
| A. |  取用药品 | B. | 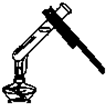 给试管加热 | ||
| C. | 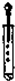 滴加液体 | D. | 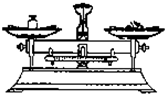 称量10.05g固体 |
分析 A.取用药品,不能用手,有些药品有毒或有腐蚀性;并且会污染药品;
B.给试管加热:先预热再集中加热,注意试管的倾斜角度;
C.使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置是否伸入到试管内或接触试管内壁.应垂直悬空在试管口上方滴加液体,防止污染胶头滴管;
D.称量物质时,物质不能直接放在托盘上,会污染托盘;且应“左物右码”.
解答 解:A.取用药品,不能用手,有些药品有毒或有腐蚀性,应用药匙或镊子,图中操作错误,故A错误;
B.给液体加热时,①先预热再集中加热,;②试管与桌面成约45°角,图中操作正确,故B正确;
C.胶头滴管伸入试管内或接触试管,会造成药品的污染,图中操作错误,故C错误;
D.物质不能直接放在托盘上,会污染托盘,并且,物质和砝码的物质放反;称量10.05g固体,精确度达不到,故D错误.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abdi | B. | cefk | C. | fghl | D. | bcegj |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未润洗就装标准液滴定 | |
| B. | 锥形瓶未用待测液润洗 | |
| C. | 滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 | |
| D. | 读取标准液读数时,滴前仰视,滴定到终点后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | NaOH | C. | Al2(SO4)3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com