
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(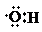 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
分析 A、Na2O2由钠离子和过氧根离子构成;
B、羟基不显电性;
C、在氢氧化钠溶液中,水的电离被抑制;
D、此反应中,每生成4mol氮气,转移15mol电子.
解答 解:A、Na2O2由2个钠离子和1个过氧根离子构成,故1molNa2O2中含3mol离子,故A错误;
B、羟基不显电性,故1mol羟基含9mol电子,故0.1mol羟基含0.9mol电子,故B错误;
C、在氢氧化钠溶液中,水的电离被抑制,溶液中的氢氧根几乎全部是由氢氧化钠电离出的,而氢离子全部来自于水的电离,故溶液中水电离出的OH-的数目N=nNA=10-13mol/L×1L×NA=10-13NA,故C错误;
D、此反应中,每生产4mol氮气,转移15mol电子,故生成28 g N2即1mol氮气转移的电子数目为3.75 NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


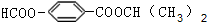 .
.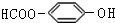 . (写结构简式)
. (写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
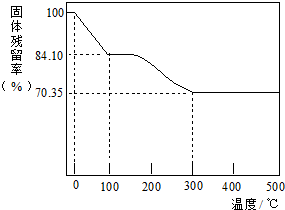
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
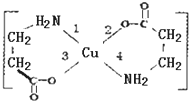 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
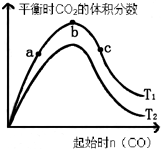 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com