
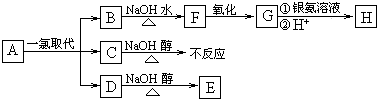
| 59.75% |
| 12 |
| 10.79% |
| 1 |
| 1-59.75%-10.79% |
| 35.5 |
| 59.75% |
| 12 |
| 10.79% |
| 1 |
| 1-59.75%-10.79% |
| 35.5 |
 ,
, ;
;

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
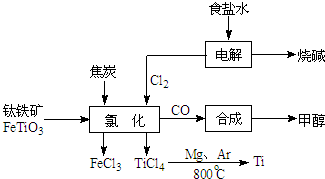
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
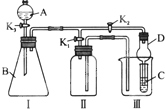 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
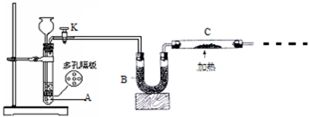 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、氯碱工业中,使用离子交换膜可防止Cl2和NaOH溶液反应 |
| C、硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量 |
| D、硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com