
| A. | F-的结构示意图: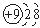 | B. | O-18的原子符号:${\;}_{10}^{18}$O | ||
| C. | NaCl的电子式: | D. | N2的结构式::N≡N: |
分析 A.氟离子的核电荷数为9,最外层达到8电子稳定结构;
B.氧原子的质量数为8,不是10;
C.氯化钠为离子化合物,电子式中需要标出所带电荷;
D.氮气分子中含有氮氮三键,结构式中不需要标出未成键电子对.
解答 解:A.F-的核电荷数为9,核外电子总数为10,其离子结构示意图为: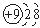 ,故A正确;
,故A正确;
B.氧原子的质子数为8,O-18的原子符号为:818O,故B错误;
C.氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故C错误;
,故C错误;
D.氮气分子中含有氮氮三键,其正确的结构式为N≡N,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度不大,涉及电子式、离子结构示意图、元素符号、结构式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
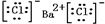 ,⑤的电子式是
,⑤的电子式是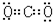 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: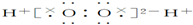 | |
| B. | NH4I的电子式: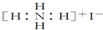 | |
| C. | 原子核内有10个中子的氧原子:1810O | |
| D. | CO2分子的结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应物总能量大于生成物总能量则反应为放热反应 | |
| B. | 电池工作时将化学能转变成电能 | |
| C. | 绿色植物光合作用过程中太阳能转变成化学能 | |
| D. | 生物质能只能通过含有生物质能的物质的直接燃烧转化成热能从而被利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
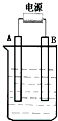 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com