
【题目】用苯作原料,不能经一步化学反应制得的是( )
A.硝基苯
B.环己烷
C.苯酚
D.苯磺酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四氯化锡是无色液体,熔点﹣33℃,沸点114℃.氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4极易水解,在潮湿的空气中发烟.实验室可以通过图装置制备少量SnCl4 (夹持装置略). 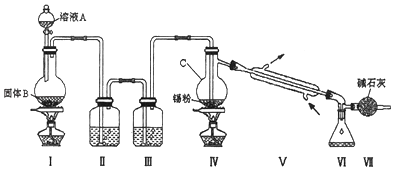
(1)仪器C的名称为:;
(2)装置Ⅰ中发生反应的离子方程式为:;
(3)装置Ⅱ中的最佳试剂为 , 装置Ⅶ的作用为;
(4)若装置连接顺序为Ⅰ﹣Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为 .
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为;
(6)若Ⅳ中用去锡粉11.9g,反应后,Ⅵ中锥形瓶里收集到23.8g SnCl4 , 则SnCl4的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁.其工艺流程如图: 
(1)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3 , 请写出TiOSO4水解成 H2TiO3沉淀的化学方程式:;铁粉的作用有:①除去溶液中的Fe3+ , ② .
(2)沉淀反应的离子方程式是 .
(3)沉淀过程的反应温度为40℃,温度不宜过高的原因除控制沉淀的粒径之外,还有 .
(4)FeC2O4生成时,要在真空环境下进行,原因是 .
(5)过滤2得到的滤液经蒸发浓缩、 , 可得到副产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.酸性高锰酸钾可以氧化苯和乙醛
D.乙烯可以与氢气发生加成反应,而苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为
A. 4︰1B. 3︰1C. 2︰5D. 1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.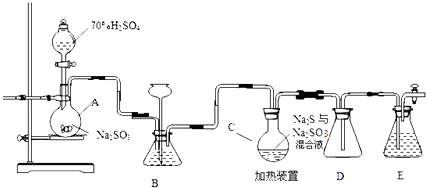
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 .
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 .
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 , 装置E的作用为
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4 , 简要说明实验操作,现象和结论: . 已知:Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为(填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为;与BA4+离子互为等电子体的一种分子为(填化学式).
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ键的数目为 .
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 . 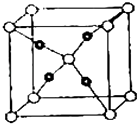
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 镁合金密度虽小,但硬度和强度较大
B. 硅酸钠的水溶液俗称“水玻璃”,是一种建筑行业常用的黏合剂
C. 海水中含量最高的非金属元素是氯元素
D. 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com