
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙 酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| C | 乙醇(乙酸) | 无 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
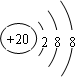 ;
;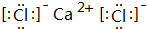
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
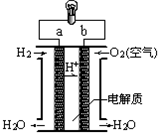
| A. | a极是负极 | |
| B. | 电流由b通过灯泡流向a | |
| C. | 正极的电极反应是:O2+2H2O+4e-═4OH- | |
| D. | 氢氧燃料电池是环保电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com