
| A、混合气体的密度保持不变 |
| B、有1mol C生成的同时有1mol D生成 |
| C、混合气体的总物质的量保持不变 |
| D、有1mol A生成的同时有1mol C消耗 |


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
 某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
 历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质是高分子化合物 |
| D、它是芳香族有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、K+、OH- |
| B、K+、NH4+、OH- |
| C、Na+、Ca2+、HCO3- |
| D、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
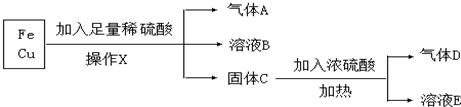
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、使用催化剂是为了加快反应速率 |
| B、增大O2浓度可以使SO2转化率达到100% |
| C、加压可以增大反应速率 |
| D、增大O2浓度可以增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com