
 .
.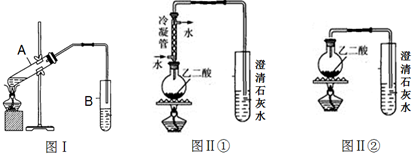
分析 (1)由电离常数可知,HC2O4-酸性大于碳酸,应生成C2O42-、二氧化碳、水;
(2)乙二酸与少量乙醇反应生成乙二酸乙酯,注意防止倒吸;
(3)如乙二酸分解,则生成二氧化碳气体,可使澄清石灰水变浑浊,但要排出乙二酸钙的影响;
(4)为防止乙二酸的影响,用冷凝管进行分离.
解答 解:(1)由电离常数可知,HC2O4-酸性大于碳酸,应生成C2O42-、二氧化碳、水,反应的离子方程式为2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-,
故答案为:2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-;
(2)乙二酸与少量乙醇反应生成乙二酸乙酯,方程式为 ,因生成物含有乙醇,易溶于水,为防止倒吸,则导管口在液面上而不伸入液面下,
,因生成物含有乙醇,易溶于水,为防止倒吸,则导管口在液面上而不伸入液面下,
故答案为:防止倒吸; ;
;
(3)①试管里澄清石灰水先变浑浊,后又变澄清,说明生成二氧化碳,二氧化碳先与氢氧化钙反应生成碳酸钙,碳酸钙与二氧化碳反应生成碳酸氢钙,
故答案为:①;
(4)乙二酸沸点较高,加热时,为防止乙二酸与氢氧化钙反应生成草酸钙对实验现象、结论有影响,则应用冷凝管进行蒸馏分离,
故答案为:冷凝回流草酸蒸气,防止生成草酸盐沉淀对CO2的检出造成干扰.
点评 本题考查性质实验的探究,侧重于学生的分析、实验能力的考查,注意把握实验的原理、目的和操作方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2mol•L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol•L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
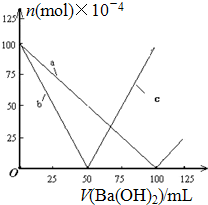
| A. | 曲线a表示Ba2+的物质的量的变化 | |
| B. | 曲线c表示OH-的物质的量的变化 | |
| C. | 加入Ba(OH)2溶液50mL时反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以鉴别羊毛和棉花 | |
| B. | 用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| C. | 用酒精清洗沾到皮肤上的苯酚 | |
| D. | 用酸性高猛酸钾溶液鉴别甲苯和苯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com