
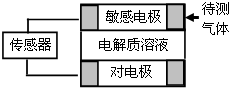
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| SO2 | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测分别含SO2和CO体积分数相同的两份体积相同的空气样本时,传感器上产生的电流大小相同 | |
| C. | 检测CO时,敏感电极上的电极反应式为CO+2OH--2e-═CO2+H2O | |
| D. | 检测NO2时,电解质溶液可选NaOH溶液 |
分析 A.失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极;
B.产生的电流大小与失电子多少有关;
C.碱性电解质环境下,敏感电极上CO失电子得到的是碳酸根离子;
D.二氧化氮可以和碱之间反应得到盐,2NO2+2NaOH═NaNO2+NaNO3+H2O,不能产生NO.
解答 解:A.失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据待测气体和反应产物可知,部分气体中元素化合价上升,部分气体中元素的化合价下降,所以敏感电极均作电池负极,故A错误;
B.产生的电流大小与失电子多少有关,检测含SO2和CO体积分数相同的两份空气样本时,二者失去电子数相等,所以产生电流大小相同,故B正确;
C.测CO时,碱性电解质环境下,敏感电极上的电极反应不可能是CO失电子得到二氧化碳,应该是得到碳酸根离子,故C错误;
D.检测NO2时,因为二氧化氮可以和碱之间反应得到盐,2NO2+2NaOH═NaNO2+NaNO3+H2O,不能产生NO,所以不能使用NaOH溶液做电解质,故D错误;
故选B.
点评 本题考查了原电池原理,根据元素化合价变化确定正负极,正确判断正负极是解本题关键,难点是电极反应式的书写,注意产生电流与相同物质的量的物质得失电子多少有关,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
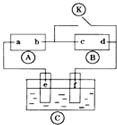 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,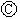 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现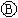 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通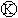 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | 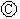 中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 向稀硝酸中加入铁粉完全反应,所得溶液一定只含一种溶质 | |
| C. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| D. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com