

分析 由方法甲可知,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据方法乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答.
解答 解:由方法甲可知,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据方法乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
(1)Ⅰ、Ⅱ中分离溶液和沉淀所采取的操作名称是过滤,过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)方法甲中,固体A为SiO2,常用作光纤、饰品、制硅、制玻璃等,
故答案为:SiO2;光纤、饰品、制硅、制玻璃等;
(3)方法乙中加入烧碱后,铝土矿中的SiO2能和氢氧化钠反应,反应的离子方程式为SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(4)检验三价铁离子的方法为:取少量滤液,滴入几滴硫氰化钾溶液,观察溶液是否变红色,
故答案为:取少量滤液,滴入几滴硫氰化钾溶液,观察溶液是否变红色;
(5)根据分析可知,沉淀Z为Al(OH)3、硅酸,最终得到的氧化铝中会混入二氧化硅,
故答案为:氧化铝中会混入二氧化硅.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水生产烧碱和氯气 | B. | 以氯气和消石灰为原料生产漂粉精 | ||
| C. | 从海水中提取单质溴 | D. | 钠在氯气中燃烧生产氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 同族元素的最外层电子数一定相同 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体元素结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOO-和CN-结合H+能力前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MO | B. | MO2 | C. | MO3 | D. | M2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
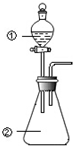 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com