
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应。
(1)O2的转化率为多少? (计算结果保留小数点后一位数字)
(2)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(3)平衡时体系中SO3的百分含量(体积分数)为多少?(计算结果保留小数点后一位数字)
科目:高中化学 来源: 题型:
氢能是一种既高效又清洁的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广;②易燃烧、热值高;③储存方便;④制备工艺廉价易行
A.③④ B.①② C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
50℃和1.01×105 Pa时,该反应能自发进行:2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,其自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:重铬酸根离子(Cr2O72—)是橙红色的,铬酸根离子(CrO42-)是黄色的,重铬酸钾溶于水发生反应:Cr2O72-+H2O  2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
。
 (2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(3)将NO2和N2O4混合气体置于恒容密闭容器中,将该体系升温至100oC,此时的现象是_________________________,原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 升高温度 ,反应重新达平衡后,HCl的体积分数不变
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学平衡常数K的说法中,正确的是( )
| A.K的大小与起始浓度有关 | B.温度越高,K值越大 |
| C.K值越大,反应物的转化率越大 | D.K值越大,正向反应进行的程度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
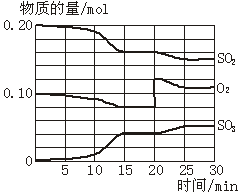 |
(1)降低温度,SO2的转化率_________,化学反应速率_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_____ ____。
(3)反应进行至20 min时,曲线发生变化的原因是_____________________ _(用文字表达)。
10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.氢氧化钠溶液和稀盐酸反应:H++OH-===H2O
B.大理石与盐酸反应制取二氧化碳:CO32-+ 2H+=== H2O + CO2↑
C.铁粉投入FeCl3溶液中:Fe + Fe3+===2Fe2+
D.用小苏打治疗胃酸过多:CO32-+ 2H+===CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com