
| A�� | ��1ml 1mol/L��NaOH����Һ�еμ�1��2��2mol/LMgCl2��Һ�а�ɫ�������ɣ��ٵμ�2��0.1mol/LFeCl3��Һ�����ֺ��ɫ��������֤��Mg��OH��2��Ksp����Fe��OH��3 | |
| B�� | ��pH=3��CH3COOH��Һ��pH=11��NaOH��Һ�������Ϻ����Һ������ | |
| C�� | ��0.1mol/L��CH3COOH��Һ��0.1mol/L��NaOH��Һ�������Ϻ����Һ������ | |
| D�� | ij���ʵ���Һ����ˮ�������c��H+��=1��10-a mol/L����a��7�������Һ��pHһ��Ϊ14-a |
���� A������������Һ����������������Ũ�ȴ�ʹþ���ӡ������ӳ�����
B��pH=11��NaOH��ҺŨ��Ϊ0.001mol/L��������������ʣ�pH=3��CH3COOH��ҺŨ��Զ����0.001mol/L���������ϵõ�CH3COOH��CH3COONa�����Һ����CH3COOH��Ũ��Զ����CH3COONa��Ũ�ȣ�
C��ǡ�÷�Ӧ�õ�CH3COONa��Һ�������ˮ�⣬��Һ�ʼ��ԣ�
D��ij���ʵ���Һ����ˮ�������c��H+��=1��10-a mol/L����a��7����Һ�ʼ��ԣ�����Ϊ�����Һ��Ҳ����Ϊ��ˮ��ʼ��ԣ�
��� �⣺A������������Һ����������������Ũ�ȴ�ʹþ���ӡ������ӳ�����������������ת�������ܱȽ�Mg��OH��2��Fe��OH��3���ܽ�ȣ���A����
B��pH=11��NaOH��ҺŨ��Ϊ0.001mol/L��������������ʣ�pH=3��CH3COOH��ҺŨ��Զ����0.001mol/L���������ϵõ�CH3COOH��CH3COONa�����Һ����CH3COOH��Ũ��Զ����CH3COONa��Ũ�ȣ�����̶ȴ���ˮ��̶ȣ���Һ�����ԣ���B��ȷ��
C��ǡ�÷�Ӧ�õ�CH3COONa��Һ��Ϊǿ�������Σ������ˮ�⣬�ƻ�ˮ�ĵ���ƽ�⣬��Һ�ʼ��ԣ���C����
D��ij���ʵ���Һ����ˮ�������c��H+��=1��10-a mol/L����a��7����Һ�ʼ��ԣ�����Ϊ�����Һ����ʱ��ҺpH=a��Ҳ����Ϊ��ˮ��ʼ��ԣ���ʱ��ҺpH=14-a����D����
��ѡ��B��
���� ���⿼����Һ������ж���pH���㡢����ˮ�⡢������ʵ��롢�ܶȻ��ȣ�ע����Һ�������pH��ϵ��D����Һ��������Ũ����ˮ����������Ũ�Ȳ�ͬ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
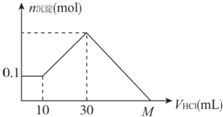 ijһ�������ʿ�����NaOH��AlCl3��MgCl2�еļ�����ɣ�����һ��������ˮ���г�������������������Һ����μ���5 mol/L�����ᣬͼ��ʾ�����������������ı仯��ϵ��ͼ��M���ʾ�Ѽ���������������M�������ǣ�������
ijһ�������ʿ�����NaOH��AlCl3��MgCl2�еļ�����ɣ�����һ��������ˮ���г�������������������Һ����μ���5 mol/L�����ᣬͼ��ʾ�����������������ı仯��ϵ��ͼ��M���ʾ�Ѽ���������������M�������ǣ�������| A�� | 70 mL | B�� | 90 mL | C�� | 100 mL | D�� | 130 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
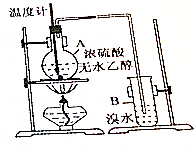 ��֪�Ҵ���Ũ������ȵ�170��ʱ��������ϩ��
��֪�Ҵ���Ũ������ȵ�170��ʱ��������ϩ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
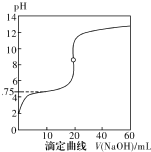 25��ʱ����0.1000mol•L-1NaOH��Һ�ζ�20mL0.1000mol•L-1һԪ��HA��pKa=-lgKa=4.75����Һ����ζ���������ͼ��ʾ������˵����ȷ���ǣ�������
25��ʱ����0.1000mol•L-1NaOH��Һ�ζ�20mL0.1000mol•L-1һԪ��HA��pKa=-lgKa=4.75����Һ����ζ���������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ������40mLNaOH��Һʱ����Һ�У�c��Na+����c��A-����c��OH-����c��H+�� | |
| B�� | ����Һ��c��H+��+c��OH-��=2��10-7ʱ��c��Na+����c��A-����c��OH-��=c��H+�� | |
| C�� | ������NaOH��Һ20mLʱc��OH-����c��H+��+c��HA�� | |
| D�� | ���ζ���pH=4.75ʱ��c��A-��=c��HA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
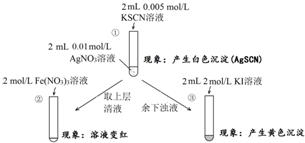
| A�� | ����Һ�д���ƽ�⣺AgSCN��s��?Ag+��aq��+SCN-��aq�� | |
| B�� | ������ɫ�仯˵���ϲ���Һ�к���SCN- | |
| C�� | ������ɫ�仯˵����AgI���� | |
| D�� | ��ʵ�����֤��AgI��AgSCN������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | pH=2��HA��Һ��pH=12��MOH��Һ����Ȼ�ϣ�c��H+��+c��M+��=c��OH-��+c��A-�� | |
| B�� | B��ˮ�������Ϻ���Һ�����ԣ���Һ�п��ܴ��ڣ�c��NH4+����c��Cl-�� | |
| C�� | ��һ���¶��£���ͬpH���������������Һ��ˮ���������c��H+���ֱ���1.0��0��10-amol/L����1.0��10-bmol/L���ڴ��¶�ʱ��ˮ�����ӻ�Ϊ1.0��10-��a+b�� | |
| D�� | �����£�0.1mol/L��HA pH=3��0.1mol/L ��BOH pH=13������BA��Һ��pH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���������� | ����������+�������� | ʧˮ������������+�������� |
| 11.70g | 14.2g | 13.2g |
| A�� | �����к��в��ֽ������ | B�� | û�з��ڸ���������ȴ | ||
| C�� | ʵ��ǰ�������������ˮ | D�� | û�н��к��ز��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ��HF��aq��?H+��aq��+F-��aq����H=+10.4kJ/mol | |
| B�� | ��V=20 mLʱ����Һ�У�c��OH-��=c��HF��+c��H+�� | |
| C�� | ��V=20 mLʱ����Һ�У�c��F-��=c��Na+��=0.1mol/L | |
| D�� | ��v��0ʱ����Һ��һ������c��Na+����c��F-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
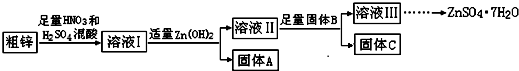
| ���� | Fe��OH��3 | Cu��OH��2 | Zn��OH��2 | CuS | ZnS |
| Ksp | 4.0��10-38 | 5.0��10-20 | 2.0��10-16 | 8.5��10-45 | 1.2��10-23 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com