
| A. | Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | Na2O2中阴、阳离子的个数比为1:1 | |
| C. | Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
分析 A.碱性氧化物是指:与酸反应只生成盐和水的氧化物;
B.过氧化钠中阴离子为过氧根离子;
C.过氧化钠与二氧化碳反应为歧化反应,过氧化钠即使氧化剂又是还原剂;
D.过氧化钠因为具有强的氧化性而具有漂白性,活性炭因为具有吸附性而具有漂白性.
解答 解:A.过氧化钠与盐酸反应产物除了生成盐和水外还有氧气,不属于碱性氧化物,故A错误;
B.过氧化钠中阴离子为过氧根离子,Na2O2中阴、阳离子的个数比为1:2,故B错误;
C.在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,消耗1mol过氧化钠转移电子的物质的量为1mol,故C正确;
D.过氧化钠因为具有强的氧化性而具有漂白性,活性炭因为具有吸附性而具有漂白性,二者漂白原理不同,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确碱性氧化物概念、过氧化钠的性质是解题关键,题目难度不大,注意过氧化钠与水、二氧化碳、酸反应中过氧化钠既表现氧化性又表现还原性.


科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的氯原子可表示为18Cl | |
| B. | 盐酸和食醋既是化合物又是酸 | |
| C. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| D. | 6.8g熔融KHSO4与3.9g熔融Na2O2中阴离子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有①②⑤ | C. | 只有①③⑤ | D. | 只有③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
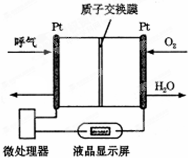 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电流由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: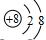 | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: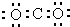 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
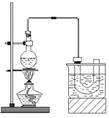 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com