
【题目】有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极. 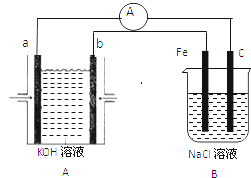
(1)b极反应式为 , a极反应式为 , C电极反应式为 .
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 , 此时要恢复原溶液的浓度需加入(填化学式).
(3)若将装置B改为电解精炼铜,则粗铜作极,阴极反应为 .
【答案】
(1)2H2﹣4e﹣+4OH﹣=4H2O;O2+4e﹣+2H2O=4OH﹣;4Cl﹣﹣4e﹣=2Cl2↑
(2)14;HCl
(3)阳;Cu2++2e﹣=Cu
【解析】解:装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极,则b为负极,a为正极,负极上氢气失电子生成水,正极上氧气得电子生成氢氧根离子,Fe为阴极,阴极上氢离子得电子生成氢气,C为阳极,阳极上氯离子失电子生成氯气,(1)b为负极,负极上氢气失电子生成水,其电极反应为:2H2﹣4e﹣+4OH﹣=4H2O;a为正极,正极上氧气得电子生成氢氧根离子,则正极的电机反为:O2+4e﹣+2H2O=4OH﹣;C为阳极,阳极上氯离子失电子生成氯气,其电极方程式为:4Cl﹣﹣4e﹣=2Cl2↑;
所以答案是:2H2﹣4e﹣+4OH﹣=4H2O;O2+4e﹣+2H2O=4OH﹣;4Cl﹣﹣4e﹣=2Cl2↑;(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,则转移电子为0.1mol,装置B中溶液中消耗0.1mol氢离子,生成0.1mol氢氧根离子,所以氢氧根离子的浓度为1mol/L,则溶液的pH为14;电解方程式为:2H2O+2Cl﹣ ![]() H2↑+Cl2↑+2OH﹣ , 溶液中减少了Cl、H两种元素,所以要加HCl恢复原溶液的浓度;
H2↑+Cl2↑+2OH﹣ , 溶液中减少了Cl、H两种元素,所以要加HCl恢复原溶液的浓度;
所以答案是:14;HCl;(3)电解精炼时,粗铜作阳极,纯铜作阴极,阴极上铜离子得电子生成Cu,则阴极反应为Cu2++2e﹣=Cu;
所以答案是:阳;Cu2++2e﹣=Cu.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1;CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.9kJmol﹣1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
O2(g)═CO2(g)△H=﹣282.9kJmol﹣1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
A.﹣41.1 kJmol﹣1
B.+200.7 kJmol﹣1
C.﹣766.5 kJmol﹣1
D.+41.1 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol MgCl2中含有 ( )
A. 3.01×1023个Mg2+B. 6.02×1023个Cl-
C. 1 mol Mg2+D. 1 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应过程的能量变化如图所示,下列说法正确的是
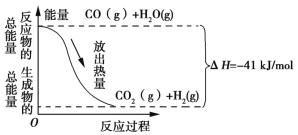
A.该反应为吸热反应
B.CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量
C.该反应的热化学方程式:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41 kJ/mol
CO2(g)+H2(g) ΔH=+41 kJ/mol
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol CO2 的质量为44g/mol
B. CO2的摩尔质量为44g
C. NA个CO2的质量与CO2的相对分子质量在数值上相同
D. CO2的摩尔质量等于CO2的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com