
 |
 |
 |
 |
| 钾与水的反应 A |
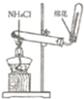
实验室制取氨气 B |
石油分馏 C |
闻气体的方法 D |
 |
 |
 |
 |
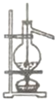
| 二氧化锰与浓盐酸反应制取氯气 E |
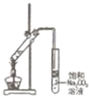
用标准液滴定待测液 F |
制取NO2气体 G |
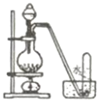
合成乙酸乙酯 H |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:阅读理解

| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕, 清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |


| 设 计 | 现 象 | |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省高三下学期第一次诊断考试理综化学试卷(解析版) 题型:实验题
)单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 |
沸点/℃ | 57.7 | - | 315 |
熔点/℃ | -70.0 | - | - |
升华温度/℃ | - | 180 | 300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是????????????????????????? 。
(2)装置C中的试剂是?????????? ; D、E间导管短且粗的原因是????????????? 。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:?????? 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操? 作 | 可能出现的现象 | 结论 |
① | 向a试管中滴加几滴????????? 溶液 | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴????????? 溶液 | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 假设2成立 | ||
③ | 向c试管中滴加几滴????????? 溶液 |
| 假设3成立 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省绵阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:实验题
单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:
|
物质 |
SiCl4 |
AlCl3 |
FeCl3 |
|
沸点/℃ |
57.7 |
- |
315 |
|
熔点/℃ |
-70.0 |
- |
- |
|
升华温度/℃ |
- |
180 |
300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是 。
 (2)装置C中的试剂是
; D、E间导管短且粗的原因是
。
(2)装置C中的试剂是
; D、E间导管短且粗的原因是
。
 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
|
序号 |
操 作 |
可能出现的现象 |
结论 |
|
① |
向a试管中滴加几滴 溶液 |
若溶液褪色 |
则假设1成立 |
|
若溶液不褪色 |
则假设2或3成立 |
||
|
② |
向b试管中滴加几滴 溶液 |
若溶液褪色 |
则假设1或3成立 |
|
若溶液不褪色 |
假设2成立 |
||
|
③ |
向c试管中滴加几滴 溶液 |
|
假设3成立 |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下
层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点
比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,
氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水
溶液),可利用如下反应: (C2H4O)n ![]() nC2H4O.
nC2H4O.
试回答下列问题:
(1)先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后_________.
(2)设计一简单实验证明久置的乙醛是否被氧化(写出简要操
作步骤、使用的试剂、实验现象和结论):______________.
(3)当n=3时,试写出(C2H4O)n的结构简式___________________________.
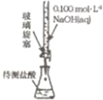
(4)提取乙醛的装置如图,烧瓶中的液体是(C2H4O)n和6mol/LH2SO4的混合物,锥形瓶中盛放蒸馏水,加热混
合物至沸腾,(C2H4O)n缓缓分解,生成的气体导入锥形瓶中.
①冷凝管中冷凝水的进口是________(填“a”或“b”).
②若实验过程中不使用冷凝管冷却,随着蒸发的进行,溶液中有黑色物质和刺激性气味气体生成.
请用化学方程式解释这一现象:_________________________.
③当锥形瓶内导管口气泡越来越少时,表明乙醛已几乎全部蒸出,实验结束.拆除实验装置的第一步操作是:____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com