
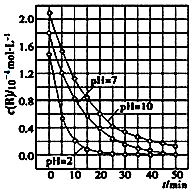
 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
分析 A、根据图中的信息可以知道在0-50min之间,pH=2和pH=7时R的降解百分率;
B、对比溶液的酸性强弱对R的降解速率的影响情况;
C、根据图中曲线可知,曲线的斜率表示反应速率,起始浓度不同分解速率不同,PH不同分解速率也不同,故R的起始浓度和溶液的PH均影响R的降解速率;
D、根据平均降解速率v=$\frac{△c}{△t}$来计算即可.
解答 解:A、根据图示可知:在0-50min之间,pH=2和pH=7时R的降解百分率是相等的,故A错误;
B、溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,故B正确;
C、根据图中曲线可知,曲线的斜率表示反应速率,起始浓度不同分解速率不同,PH不同分解速率也不同,故R的起始浓度和溶液的PH均影响R的降解速率,但R的起始浓度不同,可以判断溶液的酸碱性对R的降解速率的影响,通过分析斜率的大小来判断,故C错误;
D、在 20-25min之间,pH=10时R的平均降解速率为$\frac{0.6-0.4}{5}$×10-4=0.04×10-4mol•L-1•min-1,故D错误.
故选:B.
点评 本题考查学生的识图能力,要求学生具有分析和解决问题的能力,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
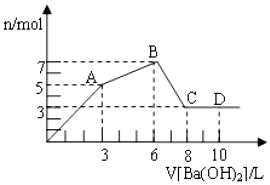 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中A点生成的沉淀是BaSO4和Al(OH)3 | |
| B. | 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | AB段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═BaSO4↓+2AlO2-+4H2O | |
| D. | 向D点溶液中通入CO2气体,立即产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
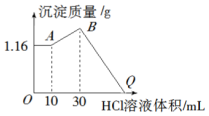 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com