
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
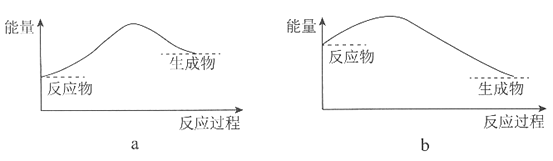
(2)该反应的能量变化可用下图中的________表示(填序号)。
(3)H2的产生速率随时间的变化如图所示。
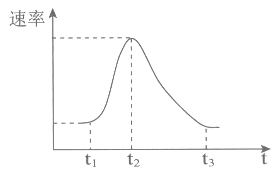
t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表;
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
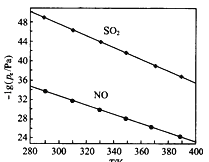
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ ClO(aq)+2OH(aq)===CaSO4(s)+H2O(l)+Cl(aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料,利用它较高的体积电阻率、绝缘强度大、导热性能好,可用作大功率半导体器件的绝缘基片、大规模和超大规模集成电路的散热基片和封装基片。工业上可用氮气和铝在高温下直接化合法来制备氮化铝粉体(AlN粉体在潮湿的空气中易发生水解反应)。已知:实验室可用饱和亚硝酸钠(NaNO2)溶液和氯化铵溶液共热制取氮气。现提供以下装置来模拟工业制取AlN粉体。
(1)写出实验室制取氮气的化学方程式:___________________________。
(2)请从下图中选择合适的装置按顺序组装一套用氮气和铝粉制AlN的装置(装置可以根据需要重复使用):________________________________。

(3)实验开始后应先给_______处装置加热一段时间再给另一处装置加热,这样操作的原因是:_______________。
(4)已知:氮化铝(AlN)既能溶于强酸,又能溶于强碱,试写出AlN与HCl溶液反应的化学方程为________________。
(5)AlN制备过程中存在一些副反应致生成的AlN不纯。 研究小组的同学取2.0500 g AlN样品与浓NaOH溶液充分反应,通过测定产生氨气的量来测定AlN的纯度(假设杂质与碱反应不生成NH3,忽略NH3在强碱性溶液中的溶解)。实验装置如下:请帮该同学纠正装置中一处明显错误:___________________。当H中反应完全后持续缓慢通入氮气将生成的氨全部吹入I中被水吸收。然后将I中氨水_________________________________________________________________________(请补充完这步操作,需根据后面数据计算作答),用_______取25.00mL氨水于锥形瓶中并加入几滴_______作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸体积为22.50mL,经计算得AlN的纯度为90.00 %。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
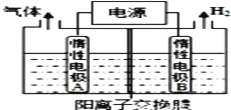
A. B极区电解液为LiOH溶液
B. 电解过程中Li+向B电极迁移
C. 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区
D. 阳极电极反应式为2Cl- - 2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑
B.铁和稀硝酸反应: Fe+2H+=Fe2++H2↑
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2 = 2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com