
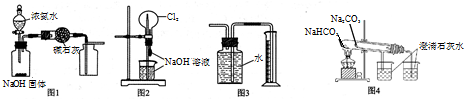
| A. | 图1装置可制取、收集干燥纯净的NH3 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可测量Cu 与浓硝酸反应产生气体的体积 | |
| D. | 图4装置可用比较NaHCO3和Na2CO3的热稳定性 |
分析 A.氨气密度小于空气,应选择向下排气法;
B.极易溶于该溶液的气体能产生喷泉实验;
C.二氧化氮溶液水,与水反应;
D.碳酸氢钠不稳定,加热易分解.
解答 解:A.氨气密度小于空气,应选择向下排气法,故A错误;
B.极易溶于该溶液的气体能产生喷泉实验,氯气极易溶于氢氧化钠溶液形成压强差,所以能形成喷泉实验,故B正确;
C.二氧化氮易和水反应生成硝酸和NO,所以不能用排水法测量二氧化氮体积,故C错误;
D.碳酸氢钠不稳定,加热易分解,而碳酸钠不分解,比较稳定性时,碳酸氢钠应放在套装内,故D错误;
故选:B.
点评 本题考查较为综合,涉及物质的分离、制备等基本实验操作的考查,侧重于实验方案的评价,熟悉实验基本常识及物质的性质即可解答,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学键的形成一定伴随着电子的得失 | |
| B. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

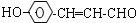 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$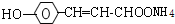 +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应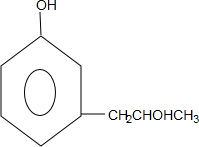 ,G的结构简式
,G的结构简式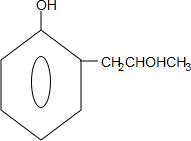 .
.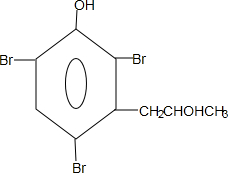 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀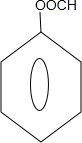 ,
,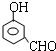 或
或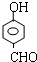 或
或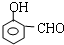 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水硫酸铜、蔗糖 | B. | 硅胶、硫酸亚铁 | C. | 食盐、硫酸亚铁 | D. | 生石灰、食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向澄清石灰水中加入少许NaOH固体,溶液不出现浑浊 | |
| B. | 向饱和Na2CO3溶液中通入CO2气体,一定有浑浊 | |
| C. | 向大量饱和CuSO4溶液中加入16gCuSO4,保持温度不变,析出晶体质量25g | |
| D. | 大量MnO2与含4mol HCl的浓盐酸共热,充分反应后生成Cl2的物质的量小于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:
某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:| 一定含有的阳离子种类 | ||||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com