
【题目】实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从上图中选择制取气体的合适装置:氮气、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,
锥形瓶中还可观察到的现象是。
(5)写出乙装置中氨氧化的化学方程式:。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、、。
【答案】
(1)a;b
(2)干燥气体;控制氢气和氮气的流速
(3)不会;因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)氨的氧化反应是一个放热反应;有红棕色气体产生
(5)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(6)NH4+;NO3-
【解析】制取氮气用氯化铵溶液和亚硝酸钠溶液加热反应生成,故选a装置,制取氢气用锌与稀硫酸反应,不用加热,选b装置。甲装置的作用是混合氮气、氢气,干燥气体,控制氮气和氢气的流速。从氨合成器中出来的气体主要是氮气和氢气,通入水中吸收氨气,因为氮气、氢气难溶于水,不会倒吸。氨的催化氧化是一个放热反应,铂丝保持红热,锥形瓶中发生下列反应:
4NH3+5O2![]() 4NO+6H2O,2NO+O2=2NO2有红棕色气体产生,
4NO+6H2O,2NO+O2=2NO2有红棕色气体产生,
3NO2+H2O=2HNO3+NO,HNO3+NH3=NH4NO3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: 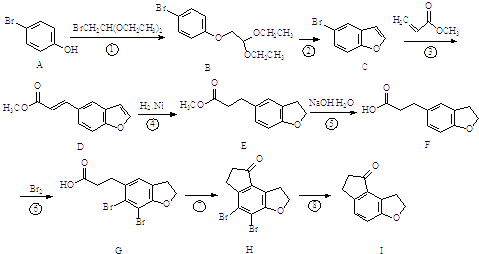
(1)反应①的类型为: , 反应④的类型为: .
(2)物质F中含氧官能团的名称为 .
(3)反应③会生成与D互为同分异构体的副产物,该反应的方程式为 .
(4)若未设计反应⑥,则化合物I中可能混有杂质,该杂质同样含有一个六元环和两个五元环,其结构简式为 .
(5)写出同时满足下列条件的物质I的一种同分异构体的结构简式 . ①能发生银镜反应;②能发生水解反应;③分子的核磁共振氢谱有5个峰.
(6)已知:CH2=CHCH2OH ![]() CH2=CHCOOH 以CH2=CHCH=CH2、
CH2=CHCOOH 以CH2=CHCH=CH2、 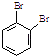 为原料,合成
为原料,合成 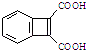 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成
流程图示例如下:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH. .
CH3CH2OH. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知H2CO3H++HCO3﹣K1=4.3×l0﹣7;
HCO3﹣H++CO32﹣K2=5.6×l0﹣11;
H2OH++OH﹣Kw=1.0×l0﹣14
现取10.6g Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )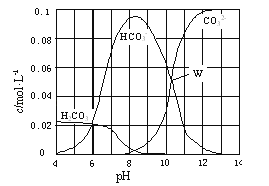
A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
B.pH=4的溶液中:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1 molL﹣1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3﹣)=c(OH﹣)+c(Cl﹣)
D.pH=11的溶液中:CO32﹣+H2OHCO3﹣+OH﹣K=1.8×l0﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3 , 含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程: 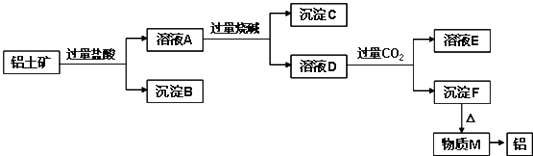
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是(填操作名称).需要用到的玻璃 仪器、、
(2)沉淀B的成分是(填化学式,下同),沉淀C的成分是、;
(3)写出生成溶液D的离子方程式;
(4)沉淀F转化为物质M的化学方程式为;溶液D中通入过量CO2生成沉淀F的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 , 放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式?
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为L,制得98%的硫酸质量为t,SO2全部转化为H2SO4时放出的热量是kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为﹣285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(1)△H=﹣445kJ/mol
CO2(g)+H2O(1)△H=﹣445kJ/mol
C.已知:2C(s)+O2(g)=2CO(g)△H=﹣221 kJmol﹣1 , 则C的燃烧热为﹣110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH﹣(aq)=H2O(1)△H=﹣57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(g)△H13H2(g)+Fe2O3(s)=2Fe(s)+3H2O(g)△H2
2Fe(s)+ ![]() O2(g)=Fe2O3(s)△H3
O2(g)=Fe2O3(s)△H3
2Al(s)+ ![]() O2(g)=Al2O3(s)△H4
O2(g)=Al2O3(s)△H4
2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1<0,△H3>0
B.△H5<0,△H4<△H3
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com