
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
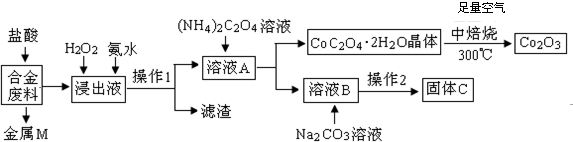
分析 合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴.
(1)上述分析判断金属M为Cu,操作Ⅰ为分离固体和液体的操作,是过滤操作;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,饱和碳酸锂溶液中碳酸根离子分布不水解,溶液显碱性;
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气.
解答 解:合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴,
(1)上述分析判断金属M为Cu,操作Ⅰ为过滤操作,故答案为:Cu;过滤;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O4?2H2O+3O2 $\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2,
故答案为:4CoC2O4?2H2O+3O2 $\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,在常温条件下,饱和Li2CO3溶液中,碳酸根离子分步水解溶液显碱性,溶液中离子浓度由大到小的排列顺序为c(Li+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
故答案为:减少Li2CO3的溶解损失;c(Li+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气,阳极上是碳酸根离子失电子发生氧化反应,阳极电极反应式为:2CO32--4e-=O2↑+CO2↑;
故答案为:2CO32--4e-=O2↑+CO2↑.
点评 本题主要考查物质的分离提纯的综合应用,为高频考点,侧重于学生的分析能力和实验能力、计算能力的考查,综合性强,注意把握实验的流程和原理,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
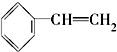 ④
④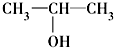 ⑤
⑤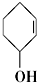 ⑥
⑥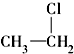 ⑦
⑦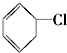 ⑧
⑧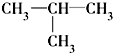 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)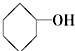 (11)
(11) ⑫CH3Cl
⑫CH3Cl
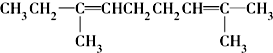 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
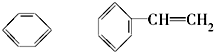
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( ) | A. | ①③⑤ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
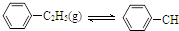 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com