
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
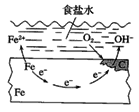
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】中学化学学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如图所示(部分产物已略去)

(1)写出用惰性电极电解M溶液的离子方程式:______________________。写出F的电子式:__________________________。
(2)若A是地売中含量最多的金属元素,将A的氯化物溶液0.2mol/L和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则氢氧化钠溶液的物质的量浓度可能为____________。
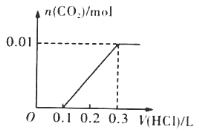
(3)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如图所示,则A与B溶液反应后溶液中的溶质为______(填化学式)。
(4)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入KSCN溶液后显红色,则由A转化成E的离子方程式是________________________________。
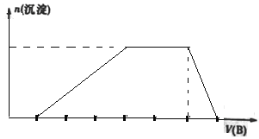
(6)若A是一种溶液,只可能有H+、NH4+、Mg2+、Fe3+、Al3+、SO42—、CO32—中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生如图所示变化,由此可知,该溶液中肯定含有的离子及其浓度之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层有2个电子的元素一定是第ⅡA族元素
B.原子外层有3个电子的元素一定是第ⅢA族元素
C.在化合物中显-1价的元素一定位于第ⅦA族
D.核外有3个电子层的离子对应的元素一定位于第三周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或数据记录不正确的是:
A.用10 mL量筒量取9.2 mL NaCl溶液
B.用酸式滴定管量取20.00 mL K2Cr2O7溶液
C.用电子(分析)天平测得铁片质量是15.5240 g
D.用托盘天平称量时,将NaOH固体放在滤纸上,称得质量为4.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
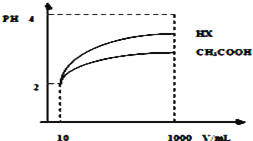
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________(填准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.10mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆向移动
B. 加入少量NaOH固体,平衡向正向移动
C. 加入少量0.10mol/LHCl溶液,溶液中C(H+)减少
D. 加入少量CH3COONa固体,平衡向正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:

a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3>I,氧化性IO3> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是

A. 0--b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B. a点时消耗NaHSO3的物质的量为1.2 mol
C. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D. 当溶液中I与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在加热条件下利用二氧化锰与浓盐酸反应来制取并收集氯气。
(1)若要制取纯净干燥的氯气,应使气体依次通过装有_______和_____的洗气瓶。
(2)实验室中若无MnO2,可用固体KMnO4代替,发生下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的气体发生装置是(填序号)___________。
a. b.
b. c.
c.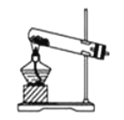
(3)某同学不慎将MnO2和KCl粉末混合了,分离该混合物的方法和步骤如下,请补充完整:先在盛有混合粉末的烧杯中加入适量的水溶解;然后____、洗涤、干燥沉淀得到MnO2;将所得液体________,即得到KCl固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com