
分析 (1)原子晶体的构成微粒为原子,分子晶体的构成微粒为分子,但稀有气体形成的分子晶体由原子构成的分子;
(2)通过非极性键形成的原子晶体为单质形成的晶体,氯化铵是含有共价键的离子晶体;
(3)含有共价键的分子晶体,熔化时破坏分子间作用力,不破坏共价键,原子晶体熔化时破坏共价键.
解答 解:(1)水晶、金刚石都是原子晶体,水晶化学成分为二氧化硅,属于原子晶体的化合物,直接由原子构成的分子晶体是稀有气体D,
故答案为:A;D;
(2)通过非极性键形成的原子晶体为金刚石,含有共价键的离子晶体是氯化铵,
故答案为:G;E;
(3)冰醋酸和白磷是含有共价键的分子晶体,熔化时破坏分子间作用力,不破坏共价键,水晶和金刚石属于原子晶体,熔化时破坏共价键,
故答案为:B、C;A、G.
点评 本题考查了化学键的类型和晶体的类型及性质,为高频考点,题目具有一定的综合性,准确判断化学键类型和晶体类型是解题的关键.


科目:高中化学 来源: 题型:选择题
| 实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
| ① | 10 | 2 | 0 |
| ② | 10 | 3 | 0 |
| ③ | 10 | 4 | 0.4 |
| A. | 实验①所得的溶液为饱和溶液 | |
| B. | 实验②所得的溶液为饱和溶液 | |
| C. | 20℃时NaCl的溶解度为30g | |
| D. | 实验①所得溶液的溶质质量分数为16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中没有游离的钠和铝 | |
| B. | 若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到水中,一定有偏铝酸钠生成 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
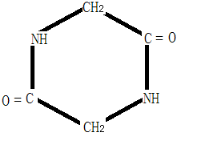 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=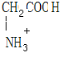 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
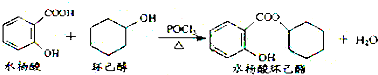
| A. | 水杨酸能分别与NaHCO3、Na2CO3溶液反应,且1 mol水杨酸分别消耗NaHCO32mol、Na2CO31mol | |
| B. | 水杨酸、环己醇和水杨酸环己酯均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol水杨酸环己酯在NaOH溶液中水解时,最多消耗3 mol NaOH | |
| D. | 1 mol水杨酸跟足量浓溴水反应时,最多消耗Br2 2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因该反应为放热反应,所以一定不必加热就可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com