
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲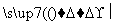 乙
乙 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏反应产物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO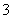 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C. NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则甲判断正确。
(3)查阅资料,发现NaHCO3固体的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO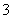 )+c(CO
)+c(CO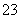 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO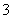 )+c(CO
)+c(CO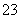 )+c(OH-)
)+c(OH-)
c.HCO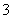 的电离程度大于HCO
的电离程度大于HCO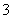 的水解程度
的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,每个离子都能影响水的电离平衡的一组是( )
A.Zn2+、Ag+、HCO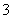 、Cl-、PO
、Cl-、PO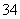 、SO
、SO B.Fe3+、Br-、Al3+、H+、CO
B.Fe3+、Br-、Al3+、H+、CO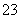 、H2PO
、H2PO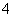
C.Ag+、SO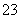 、SiO
、SiO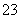 、Fe2+、S2- D.Fe2+、ClO-、NO
、Fe2+、S2- D.Fe2+、ClO-、NO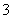 、HS-、Cu2+、HSO
、HS-、Cu2+、HSO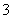
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO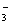 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
C.0.1 mol·L-1的NH4Cl溶液中:C(Cl-)>C(NH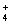 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.c(NH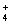 )相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
c< c<c(NH4HSO4)<c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所列各组物质中,物质之间通过一步反应就能实现如下图所示转化的是( )
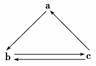
| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应有广泛应用。
(1)我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。
上述反应中,如1.5 mol还原剂________(填“得到”或“失去”)________ mol电子,则生成________ g还原产物。
(2)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH1=-3 352 kJ·mol-1
Mn(s)+O2(g)===MnO2(s) ΔH2=-521 kJ·mol-1
Al与MnO2反应冶炼金属Mn的热化学方程式是________________。
(3)高温电解技术能高效实现CO2(g)+H2O(g)===CO(g)+H2(g)+O2(g),工作原理示意图如下:
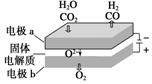
①电极b发生________(填“氧化”或“还原”)反应;
②CO2在电极a放电的反应式是__________________。
(4)黑色沉淀CuS、Cu2S放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)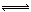 2ClNO(g) ∆H1 < 0 其平衡常数为K1
2ClNO(g) ∆H1 < 0 其平衡常数为K1
b、2NO2(g)+NaCl(s)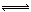 NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)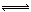 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
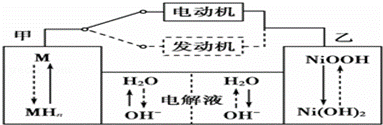
其总反应式为H2+2NiOOH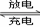 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
①w=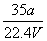 ×100% ②c=
×100% ②c=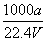
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(Cl-)>c(NH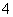 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com