
取1 g含SiO2和FeS2的矿石样品,在氧气中充分燃烧,残余固体质量为0.84 g.用这种矿石100 t,可以制得98%的H2SO4多少吨?(设生产过程中硫损失2%)
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 序号 | 实验内容要点 | 实验现象, | 结论及解释 | ||||
| (1) | 加热后,缓慢通气体 | E中澄清石灰水不变浑浊,G中澄清石灰水变浑浊 | 猜想 ① ① 成立 | ||||
| (2) | 将D装置取走,连接好其余装置, 继续反应 |
观察到E中澄清石灰水始终不 变浑浊 |
猜想 ⑦ ⑦ 不成立 | ||||
| (3) | 用pH试纸测C中混和物pH | pH试纸变为 浅红或是红 浅红或是红 色,pH=3 |
猜想④成立. | ||||
| (4) | 取C中适量混和液,滴加稍过量 碳酸氢钠溶液蒸馏,取馏出物 碳酸氢钠溶液蒸馏,取馏出物 ,再与银氨溶液反应 |
出现银镜 | 猜想③成立,银镜反应离子方程式为 HCHO+2[Ag(NH3)2]++2OH-
HCHO+2[Ag(NH3)2]++2OH-
| ||||
| … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
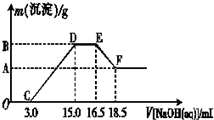 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com