
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入NaOH溶液至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
| [SO32-] |
| [HSO3-] |
| [OH-] |
| [H+] |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
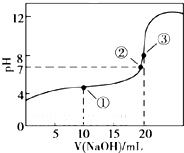 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | 加入物质 | 答案序号 |
| (1)氯化铝溶液 | 加入过量氨水 | |
| (2)饱和石灰水 | 通入过量CO2气体 | |
| (3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
| (4)含少量盐酸的氯化铝溶液 | 逐滴加入NaOH溶液 | |
| (5)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
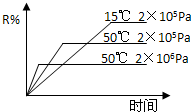 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
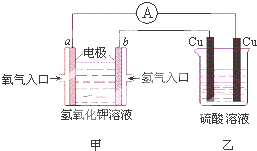 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
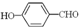 的沸点比
的沸点比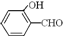 高,原因是
高,原因是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com