
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
分析 A.二氧化硫过量,次氯酸具有强氧化性,反应生成硫酸钙、硫酸和盐酸;
B.草酸为弱酸,离子方程式中草酸不能拆开;
C.铁粉过量,反应生成亚铁离子;
D.氢氧化钠过量,反应生成碳酸钙沉淀、碳酸钠和水.
解答 解:A.漂白粉溶液中通入过量SO2,二者发生氧化还原反应,正确的离子反应为:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故A错误;
B.草酸需要保留分子式,正确的离子方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,故B错误;
C.稀硝酸中加入过量铁粉,反应生成硝酸亚铁、NO气体和水,正确的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C错误;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液,反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里气体的密度为40g•L-1 | |
| B. | SO3的分解率为20% | |
| C. | 化学反应速率v(Ag2SO4)=v(SO3) | |
| D. | 在这10min内的平均反应速率为v(O2)=0.005mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 上述两个反应中,氧化产物都是H3PO4 | |
| C. | 反应(2)中,1mol CuSO4可氧化1/5molP | |
| D. | 上述两个反应中,氧化剂都只有硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离平衡常数可以表示弱电解质的相对强弱 | |
| B. | 电离平衡常数受溶液浓度的影响 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
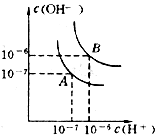 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{{r}_{N{a}^{+}}}^{\;}}{{r}_{Na}}$ | B. | $\frac{{r}_{Mg}}{{r}_{Na}}$ | C. | $\frac{{r}_{p}}{{r}_{Cl}}$ | D. | $\frac{{r}_{N}}{{r}_{p}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com