

| A. | 有机物A分子式为C10H12O3Cl | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH |
分析 有机物由C、H、O、Cl等元素组成,属于烃的衍生物,分子中含有-COO-、-Cl、-OH等官能团,可发生水解等反应,含有苯环,还可发生加成反应,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C10H10O3Cl,故A错误;
B.分子中不含C=C,则不能和Br的CCl4溶液发生加成反应,故B错误;
C.与-OH相连的碳的邻位碳原子上无氢原子,在浓H2SO4作用下,不可发生消去反应,故C错误;
D.A与足量NaOH溶液反应为: +NaCl+H2O,则1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH,故D正确.
+NaCl+H2O,则1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH,故D正确.
故选D.
点评 本题考查有机物的结构和性质,题目难度中等,本题注意把握有机物的结构和官能团的性质,易错点为D,注意发生消去反应的特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
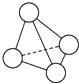 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
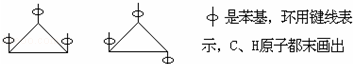
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
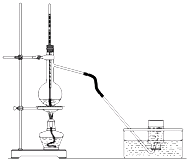 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 断裂H-H键吸收能量 | D. | 生成H-O键放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com