
| A.前者产生的氯气多 | B.一样多 |
| C.后者产生的氯气多 | D.无法判断 |
科目:高中化学 来源: 题型:
| ||
| ||

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:


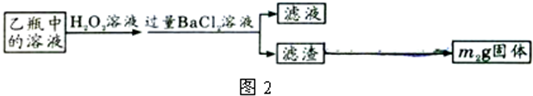
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
查看答案和解析>>
科目:高中化学 来源:湖南省月考题 题型:实验题
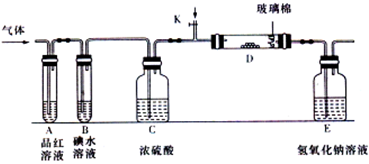
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种合金是三组分元素体系。在空气中燃烧只生成白色的氧化物,或者说可以看成是两种含氧酸盐。若将合金等分为二,第一份在足量稀硫酸中充分溶解后有Bg固体剩余;另一份投入足量的浓氢氧化钠溶液中充分溶解后,也有Bg固体剩余。若把两种剩余的固体经高温熔化,冷却后投入水中可以产生一种在空气中自燃的气体。推测合金中的组成元素,写出题中有关反应方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com