
| R | ||
| X | Y | Z |
| A、X的氢化物比R的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构 |
| D、Y、R形成化合物的化合物YR2能使KMnO4溶液褪色 |


科目:高中化学 来源: 题型:

| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL 18mol?L-1浓硫酸 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 |
| C | 2mL乙醇、1mL乙酸 6mL 3mol?L-1 H2SO4 | 0.6 |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,物质的物质的量相等,其体积一定相同 |
| B、等体积的二氧化碳和一氧化碳所含的分子数一定相等 |
| C、1L氮气一定比1L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
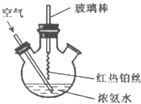
| A、反应后溶液中含有NO3- |
| B、反应后溶液中c(H+)增大 |
| C、实验过程中有化合反应发生 |
| D、实验过程中NH3?H2O的电离常数不可能发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com