
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | 钠 | 水 | 硝酸 | 小苏打 | 胆矾 |
| B | 生铁 | 硅酸钠 | H2SiO3 | KOH | NH4Cl |
| C | 晶体硅 | 过氧化钠 | 盐酸 | '纯碱 | 明矾 |
| D | 液氯 | 铁红 | 硫酸 | Ca(OH)2 | Na2SO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据物质的组成进行分析,单质是由一种元素组成的纯净物;
氧化物是指由两种元素组成其中一种是氧元素的化合物;
酸是指在电离时产生的阳离子全部是氢离子的化合物;
碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;
盐是由金属离子(或铵根离子)和酸根离子组成的化合物.
解答 解:A.胆矾是五水合硫酸铜,由硫酸根离子和铜离子构成,属于盐,小苏打是碳酸氢钠的俗称,化学式为:NaHCO3,属于碳酸的酸式盐,故A错误;
B.生铁是铁的合金,生铁中含碳量为2%~4.3%,为混合物,硅酸钠化学式为Na2SiO3,属于硅酸盐,故B错误;
C.盐酸为氯化氢的水溶液,为混合物,'纯碱为碳酸钠,化学式为Na2CO3,属于碳酸盐,故C错误;
D.液氯为氯气单质的液态形式,铁红为氧化铁属于氧化物,氢氧化钙为二元强碱,硫酸钠为硫酸的正盐,故D正确;
故选D.
点评 本题考查物质类别的判断,掌握单质、氧化物、酸、碱、盐等的特征是解答此类题的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
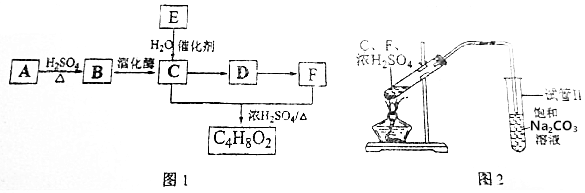
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| B. | 已知101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则该反应的反应热为221 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量 | |
| D. | 已知HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 达到平衡后,升高温度,W的体积分数减少,则此反应的△H>0 | |
| C. | 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 | |
| D. | 达到平衡后,将容器体积压缩为2L,W的物质的量浓度变为0.75mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
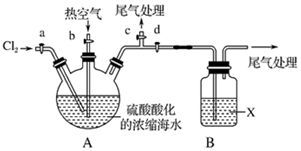
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
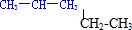 ⑥氕、氘和氚
⑥氕、氘和氚查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com