
| A. | HCl | B. | BF3 | C. | NCl3 | D. | PCl5 |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A.HCl中Cl原子最外层电子为7+1=8,H原子的最外层电子数=1+1=2,故A不选;
B.BF3中B元素的化合价为+3,B原子核外电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+7=8,F原子满足8电子结构,故B不选;
C.NCl3中,N原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故C选;
D.PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故D不选;
故选C.
点评 本题考查原子的结构,难度不大注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
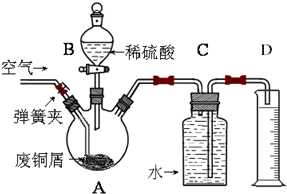
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
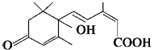 分子式为C15H20O4;
分子式为C15H20O4; 分子式C11H16
分子式C11H16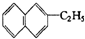 属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、Cl-、MnO4-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| C. | 加入铝粉能产生氢气的溶液中:CH3COO-、NH4+、SO42-、I- | |
| D. | 使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| C. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑ 阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2C1--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2C1--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
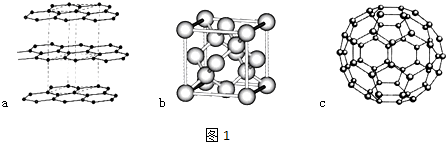
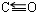 ;写出另一与CO互为等电子体的化学式CN-.
;写出另一与CO互为等电子体的化学式CN-.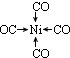 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com