
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A,请填空。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为_____ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到________(填现象) |
(2)综合上述实验现象和结论___(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_____________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点______(填“正确”或“错误”),原因是:___________。
【答案】FeS 2Fe+3Cl2![]() 2FeCl3 溶液出现血红色 能 氯气能将铁氧化到+3价,而硫只能将铁氧化到+2价,说明氯气的氧化性强于硫,故而证明氯元素的非金属性强于硫元素 Cl2+H2S=2HCl+S↓ 能 错误 应比较元素最高价含氧酸的酸性强弱而非氢化物水溶液的酸性强弱
2FeCl3 溶液出现血红色 能 氯气能将铁氧化到+3价,而硫只能将铁氧化到+2价,说明氯气的氧化性强于硫,故而证明氯元素的非金属性强于硫元素 Cl2+H2S=2HCl+S↓ 能 错误 应比较元素最高价含氧酸的酸性强弱而非氢化物水溶液的酸性强弱
【解析】
(1)由题意可知固体完全溶解,产生有臭鸡蛋气味的气体B,则B是H2S,向①的试管中加入KSCN溶液,溶液无明显变化,说明不含有铁离子,则A是FeS;⑤中铁在氯气中燃烧生成氯化铁,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3,向氯化铁溶液中滴加KSCN溶液,氯化铁溶液与KSCN溶液反应生成Fe(SCN)3,使溶液变为血红色(红色),故答案为:FeS;2Fe+3Cl2
2FeCl3,向氯化铁溶液中滴加KSCN溶液,氯化铁溶液与KSCN溶液反应生成Fe(SCN)3,使溶液变为血红色(红色),故答案为:FeS;2Fe+3Cl2![]() 2FeCl3;溶液出现血红色;
2FeCl3;溶液出现血红色;
(2)由以上实验可知,铁与氯气反应,氯气能将铁氧化为+3价氯化铁,铁与硫反应,硫只能将铁氧化为+2价硫化亚铁,说明氯气的氧化性强于硫,则氯元素的非金属性强于硫元素,故答案为:能;氯气能将铁氧化到+3价,而硫只能将铁氧化到+2价,说明氯气的氧化性强于硫,故而证明氯元素的非金属性强于硫元素;
(3)氯气能与氢硫酸溶液发生置换反应生成氯化氢和单质硫,反应的化学方程式为Cl2+H2S=2HCl+S↓,由方程式可知氯气的氧化性强于硫,则实验能验证氯元素的非金属性强于硫元素,故答案为:Cl2+H2S=2HCl+S↓;能;
(4)氢化物溶液的酸性强弱不能比较元素的非金属性强弱,则盐酸与硫化亚铁反应生成硫化氢不说明氯元素的非金属性强于硫元素,应比较元素最高价含氧酸的酸性强弱而非氢化物水溶液的酸性强弱,故答案为:错误;应比较元素最高价含氧酸的酸性强弱而非氢化物水溶液的酸性强弱。


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A.38g3H2O2中含有3NA共价键
B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.1L 0.5mol·L1 pH=7的CH3COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.天宫二号空间实验室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案的设计或描述及对应的离子方程式正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B. 将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2+ + 2HCO3- +2OH-=CaCO3↓+CO32-+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是
A.分子中有N、O、F原子,分子间就存在氢键
B.因为氢键的缘故,![]() 熔沸点高
熔沸点高
C.NH3的稳定性很强,是因为其分子间能形成氢键
D.“可燃冰” 甲烷水合物(8CH4·46H2O)中CH4与H2O之间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
____Al+____NaNO3+____NaOH=____NaAlO2+____ N2↑+___H2O
(4)若反应过程中转移5 mol 电子,则生成标准状况下N2的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】践行绿水青山就是金山银山的发展理念,就要做好大气污染和水污染防治。
(1)为落实“污水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
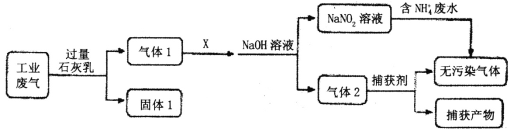
①气体l中主要含有___。
②已知X是空气,通入过量X是否合理__(填是或否),理由是__;NaNO2溶液综合处理含NH4+废水时,发生反应的离子方程式为___;捕获剂所捕获的气体成份主要是___。
(2)为了提高汽车尾气中NOx的去除率,有效降低柴油发动机在空气过量条件下的NOx排放,可以采用NSR(NOx储存还原)处理。其工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
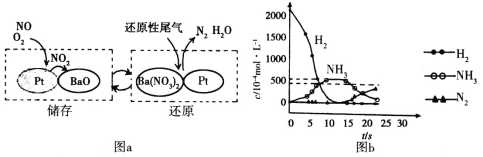
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应的化学方程式为__。
③有人根据上述模拟过程认为,使用了催化反应器虽然能将NOx转化为N2,但从环保角度汽车仍然需要限行。请简述限行的理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由3种元素组成。为确定其组成,某学习小组进行了如下实验,相关表述不正确的是( )
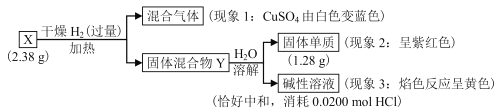
A.由现象1可以确定化合物X中含有氧元素
B.固体混合物Y的成分为Cu和NaOH
C.可以确定X的化学式为Na2Cu2O3
D.根据X的组成和相关元素的化合价预测其具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯气的三个集气瓶中,分别注入约五分之一的液体并振荡,观察下图所记录的现象,其中判断各瓶所注入的液体正确的是( )

A. ①中为硝酸银溶液B. ②中为氢氧化钠溶液
C. ③中为蒸馏水D. ③中为澄清石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com