
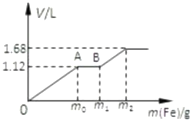
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.| 1.12L |
| 22.4L/mol |
| 0.05mol |
| 0.05L |
| 1.68L-1.12L |
| 22.4L/mol |
| 0.05mol×3+0.025mol×2 |
| 2 |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 向淀粉KI溶液中不断通入C12 | 溶液变蓝后褪色 | C12先表现氧化性后表现漂白性 |
| C | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液 | 溶液不显红色 | 黑色固体没有Fe3O4 |
| D | 将SO2通入BaCl2溶液中 | 没有白色沉淀生成 | BaSO3可溶于酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
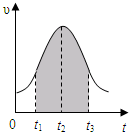 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:
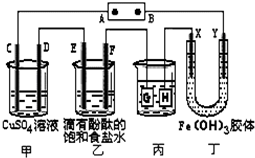 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
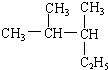
查看答案和解析>>
科目:高中化学 来源: 题型:
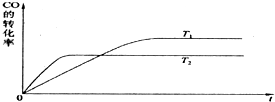 实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:
实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com