
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、周期表的16族中,第ⅢB族所含的元素种类数最多 |
| B、在周期表中,元素的族序数都等于其原子的最外层电子数 |
| C、副族元素和第Ⅷ族元素都属于过渡金属 |
| D、第ⅦA族的砹(At),其单质为有色固体,AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2溶液有氧化性,可用于杀菌消毒 |
| B、氯化镁是一种电解质,可用于电解法制镁 |
| C、液氨汽化时要吸收大量的热,可用作制冷剂 |
| D、Na2SO4能使蛋白质发生变性,可用于提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量时消耗的HCl:Na2CO3>NaHCO3 |
| B、相同物质的量时消耗的HCl:Na2CO3>NaHCO3 |
| C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v正>v逆 |
| B、v正<v逆 |
| C、v正=v逆 |
| D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个/mL |
| 加入凝聚剂 |
| 通入气体A |
查看答案和解析>>
科目:高中化学 来源: 题型:
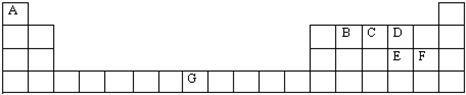
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com