
分析 (1)向混合物中加入适量水全部溶解,溶液无色透明,说明一定不会含有CuCl2,不含有不溶物或反应生成不溶物;
(2)向步骤(1)溶液中滴加BaCl2溶液生成白色沉淀,则说明该白色沉淀是碳酸钡或是硫酸钡中的至少一种;
(3)取步骤(2)的白色沉淀,白色沉淀可完全溶于稀盐酸,说明该沉淀不会是硫酸钡,所以一定是碳酸钡;
(4)往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层呈无色,则一定没有碘单质生成,所以可以确定KI一定不存在;
(5)另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是(2)中加入的氯化钡所致,以此来解答.
解答 解:(1)向混合物中加入适量水全部溶解,溶液无色透明,说明一定不会含有CuCl2,不含有不溶物或反应生成不溶物;
(2)向步骤(1)溶液中滴加BaCl2溶液生成白色沉淀,则说明该白色沉淀是碳酸钡或是硫酸钡中的至少一种;
(3)取步骤(2)的白色沉淀,白色沉淀可完全溶于稀盐酸,说明该沉淀不会是硫酸钡,所以一定是碳酸钡;
(4)往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层呈无色,则一定没有碘单质生成,所以可以确定KI一定不存在;
(5)另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是(2)中加入的氯化钡所致,
①(3)中白色沉淀为碳酸钡,可完全溶于稀盐酸,反应的化学方程式BaCO3+2HCl=BaCl2+CO2↑+H2O,
故答案为:BaCO3+2HCl=BaCl2+CO2↑+H2O;
②(5)中生成白色沉淀为AAgCl,反应的离子方程式为Ag++Cl-=AgCl↓,由以上分析可知混合物中肯定含有碳酸钠,无法确定是否含有的是NaCl,
故答案为:Ag++Cl-=AgCl↓;?Na2CO3;NaCl;
③已确定含有碳酸钠,一定不含有K2SO4、KI、CuCl2、CaCl2,如确定是否含有NaCl,可取(1)所得溶液,滴加硝酸酸化后再滴加硝酸溶液,若出现白色沉淀,说明有原固体中有NaCl,反之则无,
故答案为:取(1)所得溶液,滴加硝酸酸化后再滴加硝酸溶液,若出现白色沉淀,说明有原固体中有NaCl,反之则无.
点评 本题考查无机物的推断,为高频考点,把握白色沉淀的成分及确定一定含碳酸钠为解答的关键,侧重物质性质及发生反应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| B. | 晶体的风化、煤的液化、石油的裂化都是化学变化 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g金属钠 | B. | 1mol/L BaCl2溶液100mL | ||
| C. | 56g金属铁 | D. | 20% NaOH溶液50g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
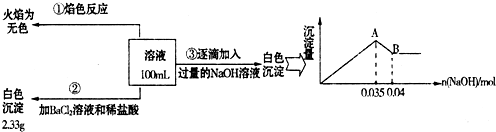
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 | |
| C. | pH=9的CH3COONa溶液和PH=9的NaOH溶液中,水的电离程度相当 | |
| D. | 以金属铝为阳极电解足量的NaOH溶液,阳极区域没有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的HCl溶液 | |
| B. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的CH3COOH溶液 | |
| C. | 向0.1mol/L的Ba(OH)2溶液中加入等体积的0.1mol/L的H2SO4溶液 | |
| D. | 向0.1mol/L的NH3•H2O溶液中加入等体积的0.1mol/L的CH3COOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com